
戦略提携室
株式会社理研イノベーションとの連携のもと、当プログラムが推進する創薬テーマ・プロジェクトについて、企業や大学、外部研究機関との共同研究やライセンシング等のアライアンス部分を担当しています。
創薬研究より開発候補品が見出されたら、候補品について、狙う疾患治療薬としての薬効確認の薬理試験、毒性試験、薬物動態や物性の評価などの非臨床試験を行い、ヒトでの安全性・有効性を調べる臨床試験に進みうるかどうかの判断を行います。低分子化合物・バイオ医薬品、再生医療等製品等のモダリティーにより状況は異なりますが、この非臨床試験の多くはガイドラインや規制に準拠して実施する必要があります。
次の画像をクリックすると拡大します
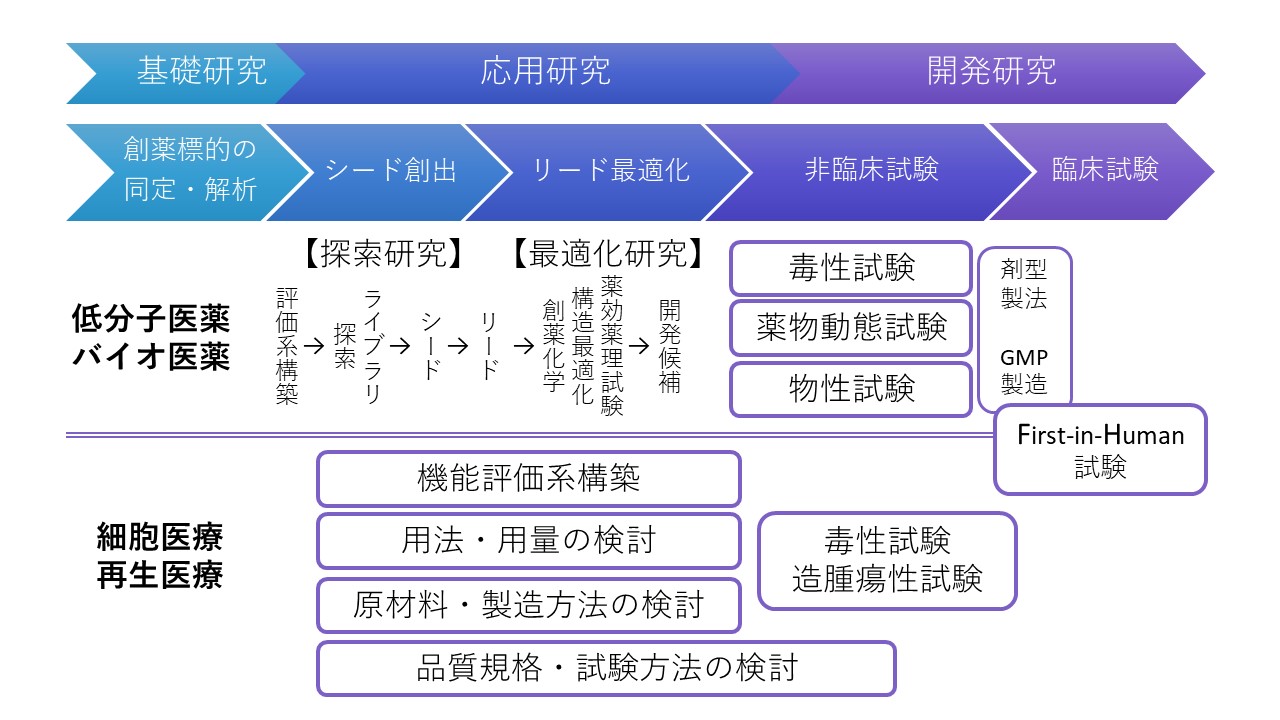
トランスレーショナルリサーチ戦略室では、製薬企業、アカデミアのTRセンター、規制当局などの業務経験者が、開発候補品について、各候補品の特徴やターゲット疾患の競合状況も考慮したうえで、最適な開発戦略を立案するとともに、その開発戦略を踏まえ臨床試験を行うために必要となる非臨床試験計画や初期フェーズの臨床試験計画についてのアドバイスなどを行い、臨床応用への橋渡しをサポートします。製品開発に関する書類整備や法規制に則った申請手続、規制当局であるPMDAとの相談・協議等も支援しています。
所属メンバーの一覧とプロフィールはマネジメントチームのページをご参照ください。