多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
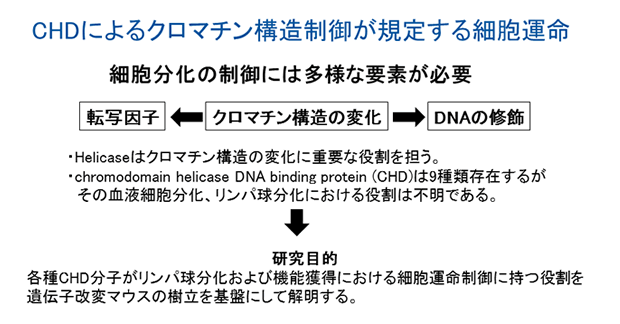
CHDによるクロマチン構造制御が規定する細胞運命
研究内容
申請者らはこれまでの研究で、細胞分化を規定することが知られているNotchシグナルによる転写調節が、リンパ球を中心とする免疫担当細胞のエフェクター細胞あるいはメモリー細胞への分化を決定していることについての研究を実施してきた(Nature Immunol 2008, Proc Natl Acad Sci USA 2008, Proc Natl Acad Sci USA 2010等)。幹細胞からの細胞分化、あるいは、成熟細胞から終末細胞分化にはクロマチン構造の変化を伴うことが知られている。その時に働く酵素の一つであるHelicaseはDNAの二重らせんや二次構造を取ったRNAなどをほどく働きを持つ。各種細胞は様々な分化過程においてDNAをほどく必要があるため多くの種類のヘリカーゼが存在している。その中で、chromodomain helicase DNA binding protein (CHD)ファミリーは哺乳動物では9種類存在しており、chromo domainとSNF2-related helicase domainを持つ遺伝子である。CHDは種を超えて保存されていることからクロマチン構造を規定する極めて重要なHelicaseであると考えられる。我々は、DNAマイクロアレイを使った研究からCHDファミリー遺伝子が血液幹細胞およびリンパ球に発現し、その発現をダイナミックに変化させていることを見出してきた。しかし、CHDファミリーの血液細胞分化、リンパ球の最終分化、メモリー細胞分化における役割は明らかにされていない。以上の背景から、本研究ではCHDファミリー遺伝子が血液細胞の自己複製および細胞分化に与える影響を明らかにすることを目的とする。
主な論文
- 安友 康二
-
Alam MS, Maekawa Y, Kitamura A, Tanigaki K, Yoshimoto T, Kishihara K, and *Yasutomo K. Notch signaling drives IL-22 secretion in CD4+ T cells by
stimulating the aryl hydrocarbon receptor.
Proc Natl Acad Sci USA 107:5943-5948, 2010Maekawa Y, Minato Y, Ishifune C, Kurihara T, Kitamura A, Kojima H, Yagita H, Sakata-Yanagimoto M, Saito T, Taniuchi I, Chiba S, Sone S, and *Yasutomo K. Notch2 integrates signaling by the transcription factors RBP-J and CREB1 to promote T cell cytotoxicity.
Nature Immunology 9:1140-7, 2008Kijima M, Yamaguchi T, Ishifune C, Maekawa Y, Koyanagi A, Yagita H, Chiba S, Kishihara K, Shimada M, and *Yasutomo K. Dendritic cell-mediated NK cell activation is controlled by Jagged2-Notch interaction.
Proc Natl Acad Sci USA 105: 7010-7015, 2008