多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
胸腺髄質上皮細胞分化機構の解明
研究内容
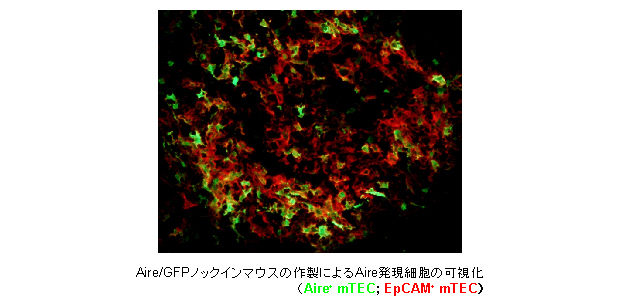
T細胞分化はT細胞自身に組み込まれた内的プログラムのみに従って進行するのではなく、胸腺上皮細胞から供給される細胞外シグナルによって、そのプロセスが制御・決定されている。このように、胸腺上皮細胞は胸腺内T細胞分化を支える重要な役割を担うにもかかわらず、純化した細胞を大量に単離することが困難であること、限られた種類の分化関連表面マーカーしか同定されていないことなどから、その細胞運命決定メカニズムの研究は大きく立ち遅れている。他方、遺伝性自己免疫疾患の原因遺伝子であるAireは胸腺髄質上皮細胞(medullary thymic epithelial cell: mTEC)に発現し、膨大な種類の自己抗原遺伝子の発現をコントロールすることによって自己反応性T細胞の除去にはたらくと考えられているが、Aire/GFPノックインマウスを用いた私どもの研究から、そのプロセスにはAireによるmTECの分化制御が関わっていることが明らかとなった。さらに、Aire発現細胞のfate mapping解析から、mTECにおけるAire発現のタイミングは従来考えられていた成熟末期ではなく、成熟の比較的早期であり、Aire発現後にもmTECの分化が進行するという新たな事実も判明した。このように、Aireは「負の選択」というT細胞分化の最終段階で外的にT細胞の運命を左右するのみならず、mTEC自身の内的運命決定にも重要な役割をはたすと考えられる。興味深いことに、最近、Aireの機能発現にはエピジェネティックな機構の関与が示唆されている。
以上の点をふまえ、本研究ではAireを切り口として、mTEC分化プロセスにおける細胞運命決定機構の解明に取り組む。得られた成果は、原因不明の難病である自己免疫疾患の原因究明にも大きな進展をもたらすものと期待している。

主な論文
- 松本 満
-
Nishikawa Y, Hirota F, Yano M, Kitajima H, Miyazaki J-i, Kawamoto H, Mouri Y, and *Matsumoto M.
Biphasic Aire expression in early embryos and in medullary thymic epithelial cells before end-stage terminal differentiation.
J Exp Med. 207: 963-971, 2010.Yano M, Kuroda N, Han H, Meguro-Horike M, Nishikawa Y, Kiyonari H, Maemura K, Yanagawa Y, Obata K, Takahashi S, Ikawa T, Satoh R, Kawamoto H, Mouri Y, and *Matsumoto M.
Aire controls the differentiation program of thymic epithelial cells in the medulla for the establishment of self-tolerance.
J Exp Med. 205: 2827-2838, 2008.Niki S, Oshikawa K, Mouri Y, Hirota F, Matsushima A, Yano M, Han H, Bando Y, Izumi K, Matsumoto M, Nakayama KI, Kuroda N, and *Matsumoto M.
Alteration of intra-pancreatic target-organ specificity by abrogation of Aire in NOD mice.
J Clin Invest. 116: 1292-1301, 2006. - 西嶋 仁
-
Takata H, Nishijima H, Ogura S, Sakaguchi T, Bubulya PA, Mochizuki T, and *Shibahara K-I.
Proteome analysis of human nuclear insoluble fractions.
Genes Cells. 14: 975-990, 2009.Nishijima H, Nakayama JI, Yoshioka T, Kusano A, Nishitani H, Shibahara K-I, and *Nishimoto T.
Nuclear RanGAP is required for the heterochromatin assembly and is reciprocally regulated by histone H3 and Clr4 histone methyltransferase in Schizosaccharomyces pombe.
Mol Biol Cell. 17: 2524-2536, 2006. - 西川 裕美子
-
Nishikawa Y, Hirota F, Yano M, Kitajima H, Miyazaki J-i, Kawamoto H, Mouri Y, and *Matsumoto M.
Biphasic Aire expression in early embryos and in medullary thymic epithelial cells before end-stage terminal differentiation.
J Exp Med. 207: 963-971, 2010.Nishikawa Y, Hikida M, Magari M, Kanayama N, Mori M, Kitamura H, Kurosaki T, and *Ohmori H.
Establishment of lymphotoxin β receptor signaling-dependent cell lines with follicular dendritic cell phenotypes from mouse lymph nodes.
J Immunol. 177: 5204?5214, 2006.