多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
マスターレギュレーターを介した相反的G1/S制御による細胞系列分岐のメカニズム

- 研究代表者
- 佐藤 健人
東海大学医学部・基礎医学系・生体防御学准教授
研究内容
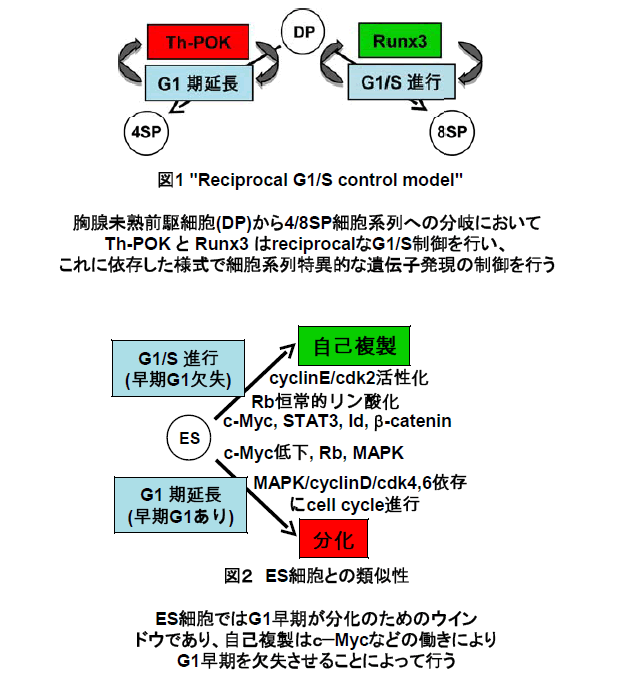
2つの細胞系列は前駆細胞からいかに分岐するか? この問題を解析するため、胸腺DP(CD4/8 double positive)細胞からヘルパー系CD4SP(CD4 single positive)細胞、またはキラー系CD8SP細胞を選択的に誘導する培養系を確立した。我々はこれを用いて、Runx3がCD4,CD8双方の遺伝子発現制御を行う事を初めて報告し(T.Sato et al. Immunity 2005)、CD8SP細胞分化のマスターレギュレーターがRunx3であるとの発見の一翼を担った。一方、CD4SP細胞の分化にはTh-POKが重要で、両転写因子のバランスが細胞系列の決定を行うと理解されるに至っている。しかし、これらの事柄は系列決定の必要条件の一つにすぎず、マスターレギュレーターとはどのようにして系列決定を導くものなのか、未だ不明の点が多い。
上記培養系は、TCRシグナルという分化の「トリガー」から、可逆的な中間段階を経て「不可逆的分化」が成立するまでの動的なプロセスを観察することを可能にした。我々はこれを用いて、「Runx3, Th-POKという二つの細胞系列のマスターレギュレーターは、G1-S期を相反的に制御し、これに依存してそれぞれの系列決定を行う」というモデルを構築するに至った。我々はこのモデルを”reciprocal G1/S control model”と名付けた。分化の結果として増殖抑制・停止の起こることがあるのは、これまでにも様々な細胞の例で知られているが、G1-Sの進行促進/阻止の制御が細胞分岐の要因をなすと言うアイディアは今のところ一般的ではない。
本研究計画では (I) このモデルは他の細胞分岐でも適用されうるか? (II)当該モデルの分子基盤は何か?Runx3は系列決定時のクロマチン構造を複製コントロールと共役して制御するか? について検討する。いわば我々が提案するモデルを、(I)横に広げ、(II)縦に深めて、その可否を問い、詳細を検討する事を企図するものである。
主な論文
- 佐藤 健人
-
Kawai Y, Hamazaki Y, Fujita H, Fujita A, Sato T, Furuse M, Fujimoto T, Jetten AM, Agata Y, Minato N.
Claudin-4 induced by E protein activity in later stages of CD4/8 double-positive thymocytes to increase positive selection efficiency
Prc.Natl.Acd.Sci.USA. 108: 4075-4080, 2011.Chiba T, Matsuzaka Y, Warita T, Sugoh T, Miyashita K, Tajima A, Nakamura M, Inoko H, *Sato T, Kimura M.
NFKBIL1 confers resistance to experimental autoimmune arthritis through the regulation of dendritic cell functions.
Scand.J.Immunol. 73:478-485, 2011.Won W, Kohu K, Chiba T, Sato T, Satake M.
Interplay of transcription factors in T cell differentiation and function: the role of Runx Immunology 132:157-164, 2011.