多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
HDAC/LSD1転写抑制複合体の異常による染色体転座形成機構の解明
研究内容
染色体転座によって生じる融合遺伝子は、慢性骨髄性白血病(CML)をはじめ種々の造血器腫瘍の原因となる。とくにCMLにおいては、染色体転座によって生じたBcr-Abl融合遺伝子産物が腫瘍細胞の増殖に必須であることが明らかにされ、その活性を阻害する薬剤imatinibによって治療成績が劇的に改善した。さらに最近、肺癌や前立腺癌などの固形腫瘍でも染色体転座があり、融合遺伝子がdriver mutationとして働いていることがわかり、治療的意義も含めて大きな注目を集めている(Nature 448: 561, 2007; NEJM 363: 1693, 2010; Nat. Med. 18: 378, 2012)。
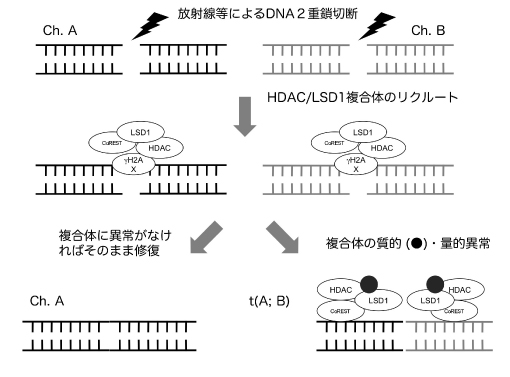
染色体転座形成のメカニズムの解明は、より有効で安全な治療やがんの予防に役立つことが期待されるが、その詳細は未だ明らかでない。疫学的研究などから、染色体転座形成の最大の誘因は放射線であることが示されている。放射線はDNA二重鎖切断を惹起するが、ほとんどの場合、non-homologous end-joining(NHEJ)またはhomologous recombinationによって元どおりに修復される。ところが、修復の際に近接する別の染色体の切断部との間で誤って結合修復がおこると転座が形成されると考えられる(Blood 93: 1197, 1999; Science 290: 138, 2000)。しかしながら、なぜそのようなエラーが起こるのかについての具体的なメカニズムは、ほとんど明らかにされていない。
申請者らは造血器腫瘍を主な対象として、発がんならびに腫瘍性維持の分子メカニズムについて、エピジェネティクスとくにヒストン修飾によるクロマチン構造の改変とその生物学的意義を中心に研究を続けている。とくにエピジェネティクに転写を抑制するヒストン脱アセチル化酵素 (HDAC) に着目し、その正常造血ならびに造血器腫瘍の発生における役割を解析してきた。その一環として、造血幹細胞においてはHDACの発現が抑制されており、多能性の維持すなわち多様な遺伝子の発現(poised gene expression)を確保していること、そのメカニズムの1つとしてmicroRNAのプロセシング抑制が関与していることを明らかにした(EMBO Rep. 13: 142, 2012)。また急性白血病においてHDACが強発現していることを見いだし、分化の阻害に働いていることをマウス移植系を用いて証明した(JBC 284: 30673, 2009)。さらに多発性骨髄腫や悪性黒色腫など難治性悪性腫瘍一般にHDACが強発現していることを確認し、とくに抗がん剤耐性に重要な役割を果たしていることを見いだした(Oncogene 25: 512, 2006、Blood 116: 406, 2010ほか)。最近、HDACのDNA修復への関与が注目を集めている。例えばMillerらは、DNA二重鎖切断部位にHDACが早期にリクルートされ、損傷部位からの転写を停止させると同時にNHEJによるDNA修復を促進することを示した(Nat. Struc. Mol. Biol. 17: 1144, 2010)。またRobertらは、HDACによるCtIPの脱アセチル化が、DNA二重鎖切断部位の断端処理に必須であることを報告している(Nature 471: 74, 2011)。
一方、lysine-specific demethylase 1(LSD1)は、ヒストンH3のlysine-4を脱メチル化する酵素で、HDACと転写抑制複合体を形成し、例えばNotch標的遺伝子の転写抑制に働くことが示されている(Mol. Cell 42: 689, 2011)。2008年にRosenfeldらは、LSD1が染色体構造をダイナミックに改変し、別々の染色体に位置するプロモーターを会合させ、転写を複合的に調節していることを報告した(Cell 132: 996, 2008)。またLSD1はアンドロジェン受容体と結合し、その転写能を制御するが、アンドロジェン受容体は前立腺癌における染色体転座形成に重要な働きをしていることが知られている(Cell 139: 1069, 2009; Nat. Genet. 42: 668, 2010)。申請者らは最近、LSD1が慢性骨髄性白血病および染色体転座を有する急性骨髄性白血病細胞で強発現していることを見いだした。一方、ヒト正常造血幹細胞・前駆細胞において発現は低レベルであった(未発表データ)。このことはLSD1もHDACと同様、造血幹細胞において発現が厳密に制御されており、その破綻が白血化の原因となる可能性を示している。
本課題は、以上に記載した申請者らのこれまでの研究成果と、他の研究グループからの最近の報告をもとに、染色体転座形成のメカニズムという古くて新しいテーマにrefineされた系を用いてチャレンジするものである。以下にworking hypothesisを示す。
主な論文
- 古川 雄祐
-
Azuma M, Koyama D, Kikuchi J, Yoshizawa H, Thasinas D, Shiizaki K, Kuro-o M, *Furukawa Y, and Kusano E.
Promoter methylation confers kidney-specific expression of the Klotho gene.
FASEB J. 26: 4264-4274, 2012.Shimizu R, Kikuchi J, Wada T, Ozawa K, Kano Y, and *Furukawa Y.
HDAC inhibitors augment cytotoxic activity of rituximab by upregulating CD20 expression on lymphoma cells.
Leukemia. 24: 1760-1768, 2010.*Ishii H, Inageta T, Mimori K, Saito T, Sasaki H, Isobe M, Mori M, Croce CM, Huebner K, Ozawa K, and Furukawa Y.
Frag1, a homolog of alternative replication factor C subunits, links replication stress surveillance with apoptosis .
Proc. Nat'l Acad. Sci. U.S.A. 102: 9655-9660, 2005. - 菊池 次郎
-
Kikuchi J, Shibayama N, Yamada S, Wada T, Nobuyoshi M, Izumi T, Akutsu M, Kano Y, Sugiyama K, Ohki M, Park S-Y, and *Furukawa Y.
Homopiperazine derivatives as a novel class of proteasome inhibitors with a unique mode of proteasome binding.
PLoS One. 8: e60649, 2013.Kikuchi J, Wada T, Shimizu R, Izumi T, Akutsu M, Mitsunaga K, Noborio-Hatano K, Nobuyoshi M, Ozawa K, Kano Y, and *Furukawa Y.
Histone deacetylases are critical targets of bortezomib-induced cytotoxicity in multiple myeloma.
Blood. 116: 406-417, 2010.Hirose K, *Inukai T, Kikuchi J, Furukawa Y, Ikawa T, Kawamoto H, Oram SH, Gottgens B, Kiyokawa N, Miyagawa Y, Okita H, Akahane K, Zhang X, Kuroda I, Honna H, Kagami K, Goi K, Kurosawa H, Look AT, Matsui H, Inaba T, and Sugita K.
Aberrant induction of LMO2 by the E2A-HLF chimeric transcription factor and its implication in leukemogenesis of B-precursor ALL with t(17;19).
Blood. 116: 962-970, 2010. - 和田 妙子
-
Wada T, Kikuchi J, and *Furukawa Y.
Histone deacetylase 1 enhances microRNA processing via deacetylation of DGCR8.
EMBO Rep. 13: 142-149, 2012.Wada T, Kikuchi J, Nishimura N, Shimizu R, Kitamura T, and *Furukawa Y.
Histone deacetylases determine the cell fate of hematopoietic progenitors.
J. Biol. Chem. 284: 30673-30683, 2009.Sekiya M, Osuga J, Nagashima S, Ohshiro T, Igarashi M, Okazaki H, Takahashi M, Tazoe F, Wada T, Ohta K, Takanashi M., Kumagai M, Nishi M, Takase S, Yahagi N, Yagyu H, Ohashi K, Nagai R, Kadawaki T, Furukawa Y, and *Ishibashi S.
Ablation of neutral cholesterol ester hydrolase 1 accelerates atherosclerosis.
Cell Metabolism. 10: 219-228, 2009.