多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
EVI1/MEL1ファミリーによる細胞運命決定能
研究内容
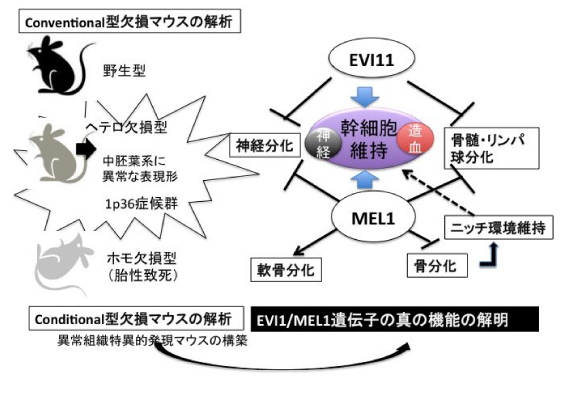
申請者らは白血病原因遺伝子候補として 3q26 染色体転座集中領域より転写因子 EVI1 を (Morishita, PNAS 1992)、t(1;3)転座 AML より MEL1(EVI1 遺伝子ファミリー)(Mochizuki, Blood 2000)を単離した。EVI1 欠損マウスの解析により、造血幹細胞維持に必須の転写因 子であるが、同時に神経系ならびに中胚葉系発達異常を同定した(Yuasa, EMBO J 2005)。 一方我々は MEL1 遺伝子が骨髄細胞分化阻害に働き (Nishikata,Blood 2003)、ATL におい ても発現亢進があり(Yoshida, Blood 2005)、また SKI 遺伝子との協調作用により転写抑 制機能を有することを明らかにしてきた (Takahata,JBC 2009)。一方 MEL1/PRDM16 promoter trap 型欠損マウスの解析等により、褐色脂肪組織筋肉分化のマスター転写因子 であり、かつ造血幹細胞維持に必須である事が報告された。さらに近年、両者が細胞質での H3K9me1 Methyltransferase 活性を有することが報告された(Cell 2012)が、この機能 と両遺伝子の有する造血幹細胞維持機能、分化マスター遺伝子としての細胞運命決定や白 血病発症との関連性は不明である。MEL1 は EVI1 と比較して幹細胞維持機構や脳神経系異常では同じ点も有 るが、さらに骨格異常や眼球の発達異常があり、機能的相違点が考えられる。また MEL1 ではこれまで報告されている筋肉脂肪組織の異常よりも、脳神経骨格系の異常が主体とな っており、既発表とは異なる細胞運命決定因子である可能性が高く、さらにはヒト 1p36 欠失症候群の原因遺伝子の一つである可能性がある。
従って、この申請ではMEL1/EVI1の造血幹細胞に対する機能的差異を中心に、脳神経系な らびに骨軟骨細胞分化系における MEL1/EVI1 の機能的差異・細胞運命決定因子としての 相違点を明らかにすることを目的とし、その先には MEL1/EVI1 高発現白血病発症機構を明 らかにすることを目標とする。
主な論文
- 森下 和広
-
Shimahara A, Yamakawa N, Nishikata I, *Morishita K.
Acetylation of lysine 564 adjacent to the C-terminal binding protein-binding motif in EVI1 is crucial for transcriptional activation of GATA2.
J Biol Chem. 285:16967-77 2010.Hidaka T, Nakahata S, Hatakeyama K, Hamasaki M, Yamashita K, Kohno T, Arai Y, Taki T, Nishida K, Okayama A, Asada Y, Yamaguchi R, Tsubouchi H, Yokota J, Taniwaki M, Higashi, Y, and *Morishita K.
Down-regulation of TCF8 is involved in the leukemogenesis of adult T-cell leukemia/lymphoma.
Blood. 112:383-393. 2008Yuasa H, Oike Y, Iwama A, Nishikata I, Sugiyama D, Perkins A, Mucenski M, Suda T, *Morishita K.
Oncogenic transcription factor Evi1 regulates hematopoietic stem cell proliferation through GATA-2 expression.
EMBO J.24:1976-1987.2005 - 今泉 和則
-
Saito A, Kanemoto S, Kawasaki N, Asada R, Iwamoto H, Oki M, Miyagi H, Izumi S, Sanosaka T, Nakashima K, *Imaizumi K.
Unfolded protein response, activated by OASIS family transcription factors, promotes astrocyte differentiation.
Nature Communications, 3: 967, 2012.Murakami T, Saito A, Hino S-I, Kondo S, Kanemoto S, Chihara K, Sekiya H, Tsumagari K, Ochiai K, Yoshinaga K, Saitoh M, Nishimura R, Yoneda T, Kou I, Furuichi T, Ikegawa S, Ikawa M, Okabe M, Wanaka A, *Imaizumi K
Signalling mediated by the endoplasmic reticulum stress transducer OASIS is involved in bone formation.
Nature Cell Biology, 11: 1205-1211, 2009.Saito A, Hino S-I, Murakami T, Kanemoto S, Kondo S, Saitoh M, Nishimura R, Yoneda T, Furuichi T, Ikegawa S, Ikawa M, Okabe M, *Imaizumi K.: Regulation of endoplasmic reticulum stress response by the BBF2H7-mediated Sec23a pathway is essential for chondrogenesis.
Nature Cell Biology, 11: 1197-1204, 2009. - 髙宮 考悟
-
Takamaya K, Mao L, Huganir RL, and *Linden DJ.
The glutamate receptor-interacting protein family of GluR2-binding proteins is required for long-term synaptic depression expression in cerebellar Purkinje cells.
J Neurosci 28:5752-5755. 2008)Hu H., Real E, Takamaya K, Kang MG, Ledoux J, Huganir RL, and *Malinow R.
Emotion enhances learning via norepinephrine regulation of AMPA-receptor trafficking.
Cell 131:160-173. 2007Steinberg JP. #, Takamaya K. #, Y. Shen, J. Xia ME, Rubin S, W Yu, Jin GM, Thomas DJ, Linden, and *Huganir RL .
Targeted in vivo mutations of the AMPA receptor subunit GluR2 and its interacting protein PICK1 eliminate cerebellar long-term depression.
Neuron 49:845-860. #Equal contribution 2006