多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
PU.1発現低下の骨髄腫発症への関与の解明
研究内容
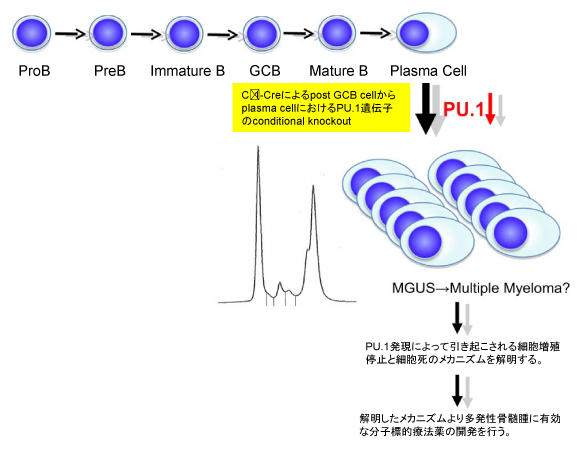
骨髄腫の発症機構は不明であり、その解明が新たな分子標的療法等を含めた治療法の確立に必須であると考えられる。多発性骨髄腫細胞株において造血に必須な転写因子であるPU.1の発現が低下しており、また多発性骨髄腫患者由来の骨髄腫細胞においてもPU.1の発現が低下している。また、PU.1の強制発現が多発性骨髄腫細胞株に細胞増殖停止と細胞死を誘導することを我々は報告した。このことは骨髄腫細胞においてPU.1の発現低下がその発症ないしは細胞増殖維持に関わっている可能性を示し、PU.1が形質細胞においては癌抑制遺伝子として働いている可能性を示唆している。我々はPU.1の発現低下が直接に多発性骨髄腫の発症に関わっているかを調べるためにPU.1をB細胞の最終分化段階であるpost germinal center B cellから形質細胞にかけてknockoutしたconditional knockout mouseを作成している。実際にはPU.1-loxPマウスと、Ig γ1 constant region gene segment (Cγ1)-Creマウスを交配することによりPU.1を形質細胞でのみ欠失させたconditional knockout mouseを作製した。現在そのphenotypeを解析中であり、半数近くのマウスにはM蛋白血症を認め、特にM蛋白量の多いマウスにおいてはその骨髄及び脾臓、肝臓、肺、腎臓などの多臓器に多数の形質細胞や未分化なB細胞リンパ腫様の細胞の浸潤を認めている。これらのマウスの骨髄細胞や脾臓細胞を免疫不全マウス(Rag2-/-Jak3-/- bulb/c)に移植すると2ヶ月以内に全例が死亡し、著明な肝脾腫を認めた。これらの形質は一部はCD138を発現しているが大部分はB220+のmature B cellであった。こららの細胞はこの免疫不全マウスに継代可能であった。さらにこれらの腫瘍細胞に対してPU.1発現を再度導入した場合にこれらの腫瘍の増殖がどうなるかを検証する予定である。
また、多発性骨髄腫細胞株にPU.1を強制発現した場合に起こる細胞増殖停止及び細胞死のメカニズムについてもPU.1発現によって発現上昇する遺伝子や発現低下する遺伝子をDNA microarrayを用いて同定し解明しているところである。このような下流の遺伝子経路を標的にした分子標的療法の開発を予定している。
主な論文
- 奥野 豊
-
Yuki H, Ueno S, Tatetsu H, Niiro H, Iino T, Endo S, Kawano Y, Komohara Y, Takeya M, Hata H, Okada S, Watanabe T, Akashi K, Mitsuya H, * Okuno Y.
PU.1 is a potent tumor suppressor in classical Hodgkin lymphoma cells.
Blood. 121: 962-970, 2013.Ueno S, Tatetsu H, Hata H, Iino T, Niiro H, Akashi K, Tenen DG, Mitsuya H, * Okuno Y.
PU.1 induces apoptosis in myeloma cells through direct transactivation of TRAIL. Oncogene. 28:4116-4125, 2009.Tatetsu H, Ueno S, Hata H, Yamada Y, Takeya M, Mitsuya H, Tenen DG, * Okuno Y.
Down-regulation of PU.1 by Methylation of Distal Regulatory Elements and the Promoter Is Required for Myeloma Cell Growth.
Cancer Research. 67:5328-5336, 2007.