多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
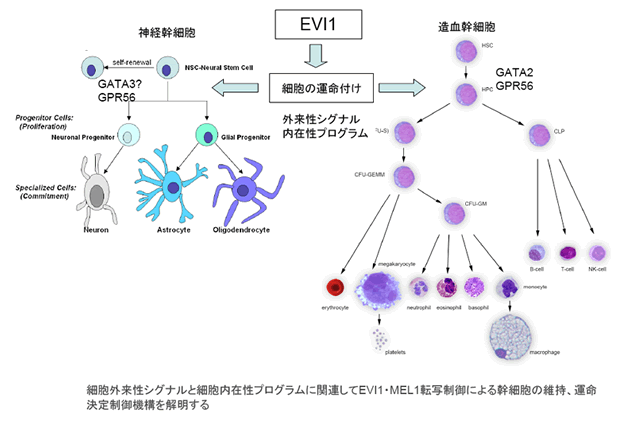
EVI1は造血及び神経幹細胞の運命を制御する
研究内容
研究目的
EVI1転写因子は難治性骨髄性白血病を引き起こす原因遺伝子である。EVI1欠損マウスは脳神経発達異常・造血異常を来し胎児死亡する。EVI1は神経幹細胞からニューロン神経細胞系へ、造血幹細胞から骨髄幹細胞への運命決定に係わる可能性が高いことから、それぞれの分子機構を明らかにし、共通項・相違点を解明し、最終的にEVI1高発現白血病の病態を明らかにする目的で本研究課題を行う。
準備状況
造血系においてはEVI1が幹細胞維持に関わり骨髄系細胞への運命決定に係わっている事から、これまでに網羅的遺伝子発現解析やChiPseqにより同定したEVI1標的遺伝子群の機能解析を進める。特にGATA-2/Ang1によるQuiescence機構の解明、GPR56/IntegrinによるNiche接着性の検討、SETBP1による細胞分化に及ぼす影響を中心に検討する。一方神経系において、EVI1は神経幹細胞で高発現し、Stemnessのマーカー遺伝子群と発現を共にし、さらにニューロン神経細胞系への運命決定ならびに神経細胞成熟過程に係わることが分かってきている。そこで既に確立したEVI1欠損マウスやConditional 欠損マウスにより脳神経系の発達異常の解析を通じて、運命決定の分子機構を明らかにする。またEVI1のターゲットであるGPR56の欠損マウスはすでに解析途中であり脳神経発達異常並びに造血異常が見られる。従ってこれらの遺伝子改変マウスの解析を通じて最終的に造血系及び神経系でのEVI1による幹細胞からの運命決定機構の共通する経路を検索する。
主な論文
- 森下 和広
-
Yuasa H, Oike Y, Iwama A, Nishikata I, Sugiyama D, Perkins A, Mucenski M, Suda T, *Morishita K.
Oncogenic transcription factor Evi1 regulates hematopoietic stem cell proliferation through GATA-2 expression.
EMBO J.24:1976-1987.2005Hidaka T, Nakahata S, Hatakeyama K, Hamasaki M, Yamashita K, Kohno T, Arai Y, Taki T, Nishida K, Okayama A, Asada Y, Yamaguchi R, Tsubouchi H, Yokota J, Taniwaki M, Higashi, Y, and *Morishita K.
Down-regulation of TCF8 is involved in the leukemogenesis of adult T-cell leukemia/lymphoma.
Blood. 112:383-393. 2008Shimahara A, Yamakawa N, Nishikata I, *Morishita K.
Acetylation of lysine 564 adjacent to the C-terminal binding protein-binding motif in EVI1 is crucial for transcriptional activation of GATA2.
J Biol Chem. 285:16967-77 2010. - 髙宮 考悟
-
Takamiya K, Mao L, Huganir RL, and *Linden DJ. The glutamate receptor-interacting protein family of GluR2-binding proteins is required for long-term
synaptic depression expression in cerebellar Purkinje cells.
J Neurosci 28:5752-5755. 2008)Hu H., Real E, Takamiya K,, Kang MG, Ledoux J, Huganir RL, and *Malinow R. Emotion enhances learning via norepinephrine regulation of AMPA-receptor
trafficking. Cell 131:160-173. 2007Steinberg JP. #, Takamiya K,. #, Y. Shen, J. Xia ME, Rubin S, W Yu, Jin GM, Thomas DJ, Linden, and *Huganir RL .
Targeted in vivo mutations of the AMPA receptor subunit GluR2 and its interacting protein PICK1 eliminate cerebellar long-term depression.
Neuron 49:845-860. #Equal contribution 2006 - 横上 聖貴
-
Yokogami K, Wakisaka S, Avruch J, Reeves SA.
Serine phosphorylation and maximal activation of STAT3 during CNTF signaling is mediated by the rapamycin target mTOR.
Curr Biol. 10:47-50. 2000