多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
ヒストン脱アセチル化酵素(HDAC)による血液細胞運命決定制御の全体像の解明
研究内容
ヒストン脱アセチル化酵素(HDAC)は、コア・ヒストンのN末に多く存在するリジン残基からアセチル基を除去する酵素の総称である。アセチル基が除去されたヒストン末端はDNAと強固に結合し、その結果、クロマチン構造がコンパクトになって遺伝子発現が抑制される。すなわちHDACはエピジェネティクな転写抑制に中心的役割を果たす分子である。哺乳類では現在までに18種類が同定されており、構造の違いからclass IからIVに大別される。とくに重要なのがclass I(HDAC1, -2, -3, -8)で、ユビキタスに発現しており、種々の転写抑制複合体のコンポーネントとして機能している。Class Iの中でもHDAC1は細胞内のHDAC活性の半分以上を担っており、HDAC1のノックアウト・マウスが胎生早期に死亡することからわかるように、他のHDACでは代償できない重要な働きをしている。
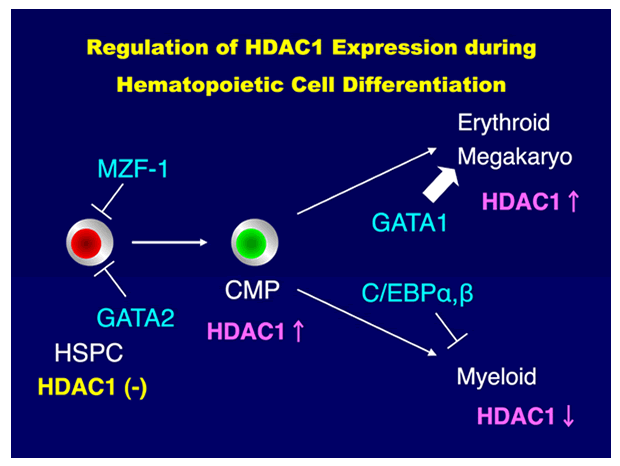
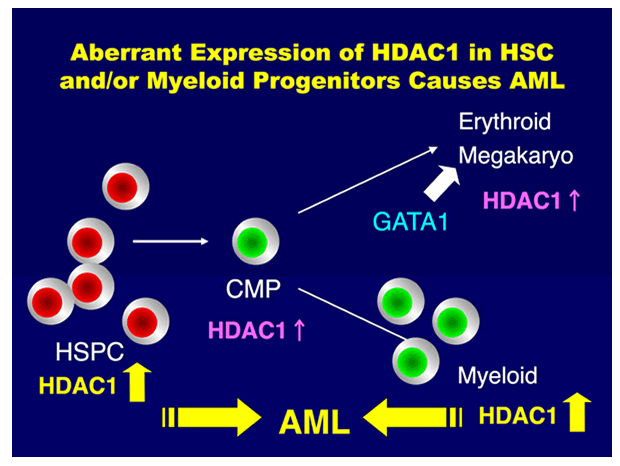
Class I HDACは様々な細胞タンパクと結合し、転写抑制複合体を形成する。代表的なものとして、N-CoR/SMRT・CoREST・Mi-2/NuRD複合体が知られており、それぞれホルモン応答・神経分化・クロマチン再構成に関与する。我々もHDACがpRB/E2Fと複合体を形成し、血球分化に伴う細胞周期促進遺伝子の発現抑制や造血前駆細胞のアポトーシス制御に重要な役割を果たすことを明らかにしてきた(JBC 272: 12406, 1997; Oncogene 18: 2003, 1999; JBC 277: 39760, 2002; Stem Cells 25: 2439, 2007ほか)。引き続きHDACの造血器腫瘍発生における役割について研究を進め、造血幹細胞においてはHDAC発現が抑制されており、多様な遺伝子の発現確保すなわち多能性の維持に寄与していること、急性白血病においてはHDACが強発現しており、分化停止に関与していることを幹細胞移植実験にて示した(JBC 284: 30673, 2009:図参照)。さらに多発性骨髄腫・マントル細胞リンパ腫・悪性黒色腫などの難治性悪性腫瘍でもHDACが強発現しており、とくに抗がん剤耐性に重要な働きをしていることを見いだした(Oncogene 25: 512, 2006; Blood 116: 406, 2010ほか)。このように正常造血細胞で発現が低く、悪性腫瘍で強発現しているHDACは良い治療標的と考えられ、実際、HDAC活性を阻害する種々の低分子化合物が抗がん剤として働くことが報告されている。我々もHDAC阻害剤が抗CD20抗体リツキサンの効果増強作用や免疫療法のアジュバント効果を有し、新しいタイプの抗がん剤として期待できることを示した(J. Invest. Dermatol. 128: 1506, 2008; Leukemia 24: 170, 2010ほか)。
以上の知見は、HDACが血液細胞の分化・悪性化・薬剤感受性の決定などに重要な役割を果たしていることを示唆する。本研究は以上の研究成果をもとに、より厳密な系すなわち造血幹細胞を含む血液系全般およびBリンパ球特異的にHDAC1を強発現するトランスジェニック・マウスを用いて、HDACによる血液細胞の運命制御の全体像を明らかにしようとするものである。具体的には、1)HDACによる造血幹細胞機能の制御とその分子基盤の解明、2)HDAC強発現による腫瘍発生機序の解明、3)抗がん剤耐性誘導のメカニズム解明とその克服の3つをテーマとして研究を進める。
主な論文
- 古川 雄祐
-
Shimizu R, Kikuchi J, Wada T, Ozawa K, Kano Y, and *Furukawa Y.
HDAC inhibitors augment cytotoxic activity of rituximab by upregulating CD20 expression on lymphoma cells.
Leukemia. 24: 1760-1768, 2010.Odgerel T, Kikuchi J, Wada T, Shimizu R, Kano Y, and *Furukawa Y.
MSK1 activation in acute myeloid leukemia cells with FLT3 mutations.
Leukemia. 24: 1087-1090, 2010.*Ishii H, Inageta T, Mimori K, Saito T, Sasaki H, Isobe M, Mori M, Croce CM, Huebner K, Ozawa K, and Furukawa Y.
Frag1, a homolog of alternative replication factor C subunits, links replication stress surveillance with apoptosis .
Proc. Natl Acad. Sci. USA. 102: 9655-9660, 2005. - 菊池 次郎
-
Kikuchi J, Wada T, Shimizu R, Izumi T, Akutsu M, Mitsunaga K, Noborio-Hatano K, Nobuyoshi M, Ozawa K, Kano Y, and *Furukawa Y.
Histone deacetylases are critical targets of bortezomib-induced cytotoxicity in multiple myeloma.
Blood. 116: 406-417, 2010.Hirose K, *Inukai T, Kikuchi J, Furukawa Y, Ikawa T, Kawamoto H, Oram SH, Gottgens B, Kiyokawa N, Miyagawa Y, Okita H, Akahane K, Zhang X, Kuroda I, Honna H, Kagami K, Goi K, Kurosawa H, Look AT, Matsui H, Inaba T, and Sugita K.
Aberrant induction of LMO2 by the E2A-HLF chimeric transcription factor and its implication in leukemogenesis of B-precursor ALL with t(17;19).
Blood. 116: 962-970, 2010.Kikuchi J, Shimizu R, Wada T, Ando H, Nakamura M, Ozawa K, and *Furukawa Y.
E2F-6 suppresses growth-associated apoptosis of human hematopoietic progenitor cells by counteracting proapoptotic activity of E2F-1.
Stem Cells. 25: 2439-2447, 2007. - 和田 妙子
-
Wada T, Kikuchi J, and *Furukawa Y.
Histone deacetylases enhance microRNA processing through deacetylation of DGCR8.
Proc. Natl. Acad. Sci. USA, submitted for publication.Wada T, Kikuchi J, Nishimura N, Shimizu R, Kitamura T, and *Furukawa Y.
Histone deacetylases determine the cell fate of hematopoietic progenitors.
J. Biol. Chem. 284: 30673-30683, 2009.Sekiya M, Osuga J, Nagashima S, Ohshiro T, Igarashi M, Okazaki H, Takahashi M, Tazoe F, Wada T, Ohta K, Takanashi M., Kumagai M, Nishi M, Takase S, Yahagi N, Yagyu H, Ohashi K, Nagai R, Kadawaki T, Furukawa Y, and *Ishibashi S.
Ablation of neutral cholesterol ester hydrolase 1 accelerates atherosclerosis.
Cell Metabolism. 10: 219-228, 2009.