私たちの化学遺伝学研究は、新しい生理活性物質を手に入れるところから始まります。生理活性物質を取得するための探索系は、研究者のアイディアにしたがって構築していきます。例えば、ヒト遺伝子を薬剤超感受性の分裂酵母に導入した「ヒト化酵母」を用いて、ヒト遺伝子の過剰発現で引き起こされる致死的な表現型を回復する化合物を得ることで、ヒト遺伝子産物の機能阻害剤を取得することに成功しています(図1)。また、タンパク質SUMO化を調節する化合物は、細胞膜を透過性にした細胞(セミインタクト細胞)に対して蛍光標識したSUMOやSUMO化酵素などを添加して細胞内の核膜上で反応を行う蛍光検出法を使っています。さらに、細胞のリプログラミングや分化を誘導する物質は、遺伝子発現を可視化した細胞系を用い、一方、エピジェネティクスを制御する化合物は、個々のヒストン修飾酵素の反応を合成蛍光基質で高感度に測定する方法などを使っています。実際のハイスループットスクリーニングには、理研創薬医療技術基盤プログラムと共同で整備したわが国有数の化合物スクリーニング施設を利用しています。
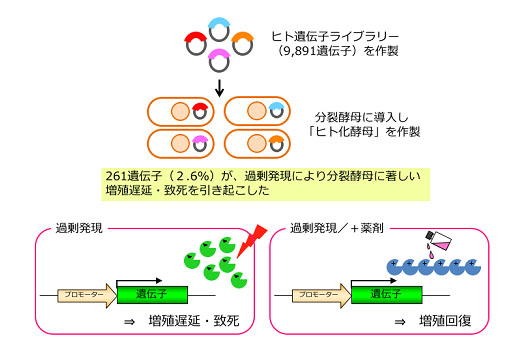
図1.分裂酵母に増殖抑制を引き起こすヒト遺伝子の同定とその表現型を用いた薬剤探索系
2.生理活性物質の作用機序解明研究
低分子有機化合物は、時として驚くべき生理活性を示します。それらの生理活性物質の活性発現メカニズムの解明は、医薬品開発の応用面にとどまらず、生命現象の根幹となる分子機構を解明し、新しい創薬標的を生み出す点で重要な研究分野となります。私たちは遺伝学における突然変異の代わりに特異な生理活性(表現型)を示す化合物を出発点とし、その原因となる標的分子を同定し、機能を明らかにする「化学遺伝学」により、ヒストン脱アセチル化酵素(HDAC)、タンパク質核外輸送因子(CRM1)、スプライシング因子(SF3b)などを真核生物の遺伝子発現を制御する決定的な因子として同定してきました。また、これらは今日の重要な創薬標的として注目されています。化学遺伝学では、突然変異を用いる遺伝学と異なり、標的遺伝子塩基配列にダメージを与えず、迅速、可逆的に遺伝子機能阻害を誘導できることから複雑で冗長性のある高等動物の遺伝子機能解析に優れている一方で、生理活性物質の作用機構研究は従来、生化学的に試行錯誤を繰り返し、研究の成否は研究者の経験と勘にゆだねられる部分が大きいのが欠点でした。そこで私たちは、最先端の分子遺伝学を基盤にポストゲノムツールと合成化学的アプローチを組み合わせ、論理的、組織的に薬剤標的分子を同定する方法論を確立し、独自のケミカルゲノミクスへと発展させようとしています。その主なツールは、(1)分裂酵母全ゲノムORFのクローン化(ORFeome)とその発現によるケミカルゲノミクスとリバースプロテオミクス(図2)、(2)バーコード化shRNAライブラリーによるプール細胞の薬剤感受性試験系、(3)培養細胞内でのスリーハイブリッドなスプリットルシフェラーゼ(NanoBiT)発光補完法による薬剤標的タンパク質をコードするヒトcDNAの同定法です。これらの方法論を開発・改良することで、これまで作用機序が未解明であった生理活性物質の標的の同定を進めています。
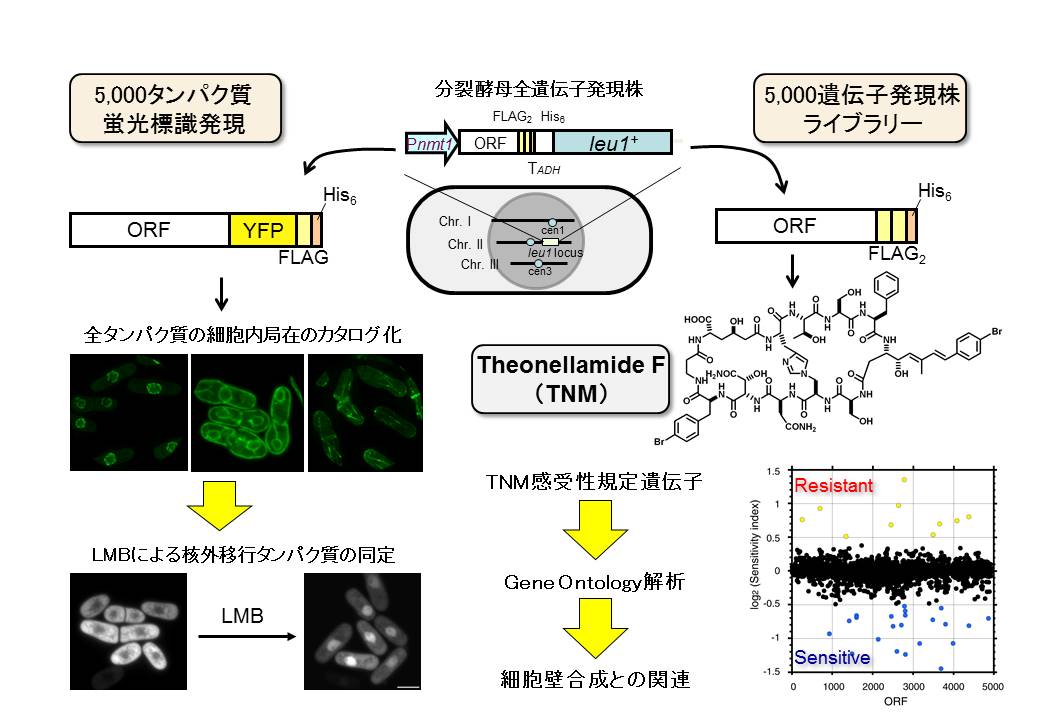
図2.分裂酵母ORFeomeを用いたケミカルゲノミクス研究
分裂酵母ゲノムにコードされる約5,000の遺伝子全てをクローン化し、1つずつ染色体に導入して誘導発現が出来る菌株を複数セット作製した。例えば左の1セットには蛍光タンパク質との融合タンパク質として発現する約5,000株、右側ではFLAGとHisタグを発現するセットであり、それぞれ化合物によるタンパク質細胞内局在の変化、化合物への感受性が変化する遺伝子を網羅的に探索することができる。
3.薬剤の作用を生きた細胞で観察するライブイメージング法の開発
私たちは現在、同じ遺伝子配列を持ちながら、異なる遺伝子発現パターンを娘細胞に継承する遺伝情報制御機構であるエピジェネティクスに関心を持っています。特にヒストンアセチル化やメチル化が細胞内でどのように制御されているか、またそれらを阻害する化合物はどのように作用するかを研究するため、FRETを用いたライブイメージング法の開発を行っています(図3)。これまでにヒストンH4 K5/K8のアセチル化やヒストンH4 K12、ヒストンH3K9/K14のアセチル化をリアルタイムで可視化するセンサープローブを開発し、抗がん活性のあるヒストン脱アセチル化酵素阻害剤の作用を細胞内で可視化することに成功しました。現在はさらにヒストンメチル化の可視化に取り組んでいます。
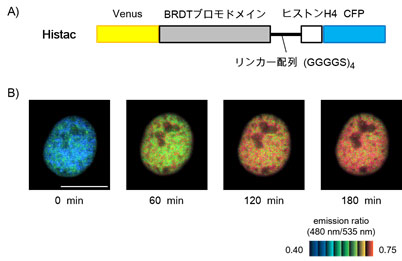
図3.生細胞でヒストンアセチル化の変化をリアルタイムで検出する蛍光プローブ
アセチル化検出プローブ(Histac)の構造(A)とFRET応答反応によるヒストンアセチル化の検出(B)。スケールバーの長さ:10 µ m
4.タンパク質アセチル化とアシル化の機能解析
私たちは世界で初めて特異的なタンパク質脱アセチル化酵素(HDACまたはKDAC)の阻害剤を発見しました。HDAC阻害剤は強い抗がん活性を示し、その一部は実際に臨床現場で医薬品として使用されていますが、そのメカニズムにはまだよくわかっていません。その理由は、HDACがヒストンだけでなく、他の多くのタンパク質のアセチル化を制御することにあるのではないかと考えています。そこで、重要なタンパク質がアセチル化によって制御される例を調べ、そのアセチル化がどのような機能を持っているかについて研究しています。これまでに微小管を構成するタンパク質チューブリンのアセチル化は微小管の安定性に、ウイルスがんタンパク質T抗原のアセチル化はそれ自身の安定性に関与することなどを明らかにしてきましたが、最近、活発に転移・浸潤を行うがん細胞の運動性に関わるタンパク質など、さらに多くの制御タンパク質がアセチル化されていることを見いだし、その機能解明に努めています。
一方、近年、タンパク質のリジン残基にはアセチル化だけではなく、より長いアシル基による修飾が起こることがわかり、HDACは脱アセチル化だけではなく、脱アシル化酵素としても働く場合があることがわかってきました。SIRT2はNADを補酵素として用いるSirtuinファミリーの脱アセチル化酵素ですが、最近、私たちはSIRT2が長鎖アシル基の脱アシル化酵素としても機能することを明らかにしました。そしていくつかの特異的SIRT2阻害剤は、長鎖アシル基のためのポケットに入ることを見いだしました(図4)。不思議なことにこれらの阻害剤はSIRT2の脱アセチル化酵素活性は強く阻害するものの、脱アシル化酵素活性は全く阻害しませんでした。そのメカニズムの研究から、内在性脂質によるSIRT2の脱アセチル化と脱アシル化の活性に切り替えの機構が存在することが示唆されました。そこで現在、Sirtuinが生体内の栄養環境に応じてタンパク質アセチル化とアシル化を制御する機構の解明を目指した研究を行っています。
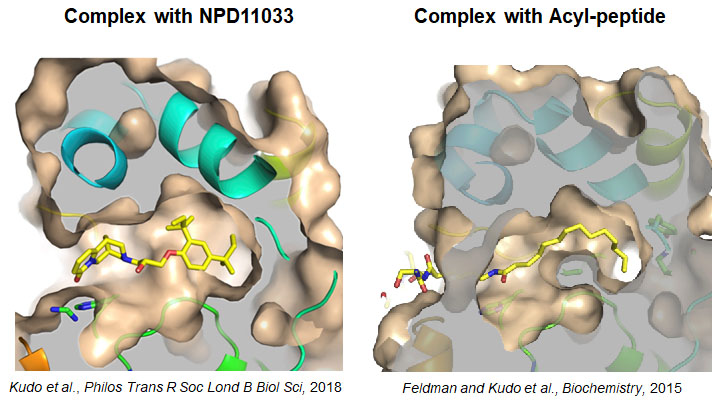
図4.SIRT2とSIRT2阻害剤(左)およびアシル化ペプチド(右)との共結晶構造
SIRT2に阻害剤を加えると、新たに深い疎水ポケットが形成され、阻害剤と複合体を形成する。アシル化ペプチドとの複合体も全く同じ疎水ポケットが形成されたことから、このポケットは脱アシル化反応のためのものであることが明らかになった。
5.抗がん物質スプライソスタチンAの作用機序研究
FR901464は藤沢薬品工業で発見された微生物由来抗がん活性物質ですが、その作用機構は長く不明でした。私たちは、スプライソスタチンA(SSA)と命名したFR901464のメチルケタール体が化学的に安定で高活性であることを利用し、SSAのビオチン化誘導体を合成し、結合タンパク質を解析したところ、スプライソソームU2 snRNPの構成成分であるSF3b複合体を同定しました。興味深いことにSF3bの機能欠損の結果、スプライシングが阻害されるだけでなく、一部のmRNA前駆体が細胞質に漏出し、イントロンを含むタンパク質が翻訳されてしまうことがわかり、SF3bがスプライシングを受ける前の未成熟なmRNAの核内保持にも関わることが示されました。すなわち、SSAはスプライシングを阻害してイントロンを蓄積させたり、その配列をタンパク質に翻訳させたりできる初めての化合物であるということができます。イントロンにはこれまでわかっていない機能があると考えられることから、SSAを使って、スプライシングと遺伝子発現の知られざる関係やイントロンの新しい機能を明らかにするための研究を行っています。例えば、スプライシング因子SF3bの機能低下により、スプライシングの上流に当たる転写制御に関わるヒストン修飾が変化することや下流に当たる翻訳が変化し、特定のグループのmRNAの翻訳が低下することがわかってきました。現在、そのメカニズムの解明に取り組んでいます。
6.微生物や藻類のエネルギー代謝制御法の開発
ケミカルバイオロジーの応用範囲は、創薬だけではありません。私たちは、エネルギー生産など地球規模の問題の解決にもケミカルバイオロジーを用いて挑戦しようとしています。その1つがエネルギー生産への応用です。アルコール発酵をする酵母や光合成によって油脂生産をする藻類のエネルギー代謝を理解し、化合物によって生産性を制御することを目指しています。例えば、私たちは酸素に応答して酸素呼吸を活性化にするメカニズムの一つとして翻訳因子eIF5Aのハイプシン化という翻訳後修飾に着目しています。酸素濃度が低下すると、酸素を必要とする反応であるハイプシン化がうまく行かなくなり、その結果ミトコンドリアの機能が低下することがわかってきました。酵母の酸素応答に関わるハイプシン化関連酵素の変異体では、酸素呼吸が低下し、その代わりにアルコール発酵能が高まっていました。そこで、私たちはeIF5Aのハイプシン化を化合物で制御できるようにしようと考えています。
また、クラミドモナスなどの藻類において油脂生産のスイッチを入れるためには、窒素源を減らす必要があります。ところが、細胞増殖には窒素源が不可欠です。そのため、細胞が増えるまでは窒素源を与え、油脂生産させるときには窒素源を除去する必要がありますが、窒素源の除去には多大なエネルギーが必要となります。そこで、窒素源があっても油脂生産のスイッチが入るような化合物の探索を進めています。
一般に微生物において、炭素源と窒素源の利用は相互に関連し合っていますが、最近、私たちは分裂酵母において利用する窒素源を選択する機構に、ごく微量のシグナル物質(窒素源シグナリング因子)を介した細胞間コミュニケーションが存在することを明らかにしました。この因子による情報を受け取った細胞は、窒素源としては利用しにくい分岐鎖アミノ酸を利用することができるようになります。しかも一旦、因子を受け取って分岐鎖アミノ酸を吸収できるようになった細胞は、もはや因子がなくても数世代にわたってその能力を維持することができます。現在、細胞内のシグナル伝達機構や窒素代謝の記憶に関わるメカニズムの解明に取り組んでいます。
7.糸状菌の脱窒制御法の開発
地球上の窒素サイクルは、根粒菌などの窒素固定菌によって作られるアンモニアや有機体窒素が微生物によって最終的に分子状窒素に変換されて大気に戻ることによってバランスが取れていました。ところが、20世紀初頭に登場したハーバーボッシュ法によってアンモニアが化学合成できるようになると、大量の窒素肥料が利用できるようになりました。その結果、食糧生産は飛躍的に向上し、人類を飢餓から救い、地球上の人口爆発に貢献しましたが、一方で窒素化合物による地球規模の汚染も引き起こしています。特にCO2の300倍もの温室効果をもち、オゾン層破壊の原因となる有害な亜酸化窒素(N2O)の発生量が急増しているのです。土壌中では、硝化細菌の力によってアンモニアは硝酸に変換され、それが植物によって窒素源として吸収されますが、同時に脱窒という嫌気呼吸を行う微生物が植物と硝酸を取り合っています(図5)。近年、嫌気性細菌だけでなく、陸上の好気的な環境を好む糸状菌(カビ)にも脱窒する能力があることがわかってきましたが、カビの脱窒系には最後のN2を作る酵素がありません。そのため、有害なN2Oを大量に放出していることがわかってきました。従って、化学肥料によって供給される硝酸からのカビ脱窒を少しでも抑えることができれば、植物に利用される硝酸が増えることで化学肥料の使用量を減らすことができるだけでなく、有害ガスであるN2Oの発生も抑制することができると考えられます。そこで、私たちはカビの脱窒反応を抑えることのできる環境に優しい化合物を探索しています。
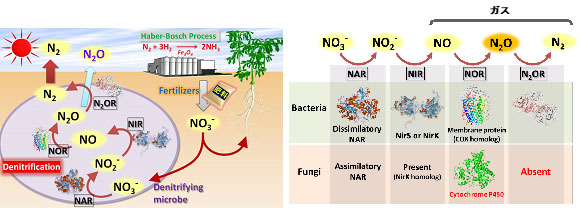
図5.施肥から発生する温室効果ガス亜酸化窒素の抑制法開発
脱窒反応に関わるNIRまたはNORを阻害する化合物を開発し、窒素肥料に添加することにより肥料効率の上昇と亜酸化窒素放出の削減を目指す。
8.老化制御に関する研究
(1) 代謝物による寿命延長効果の解析
モデル生物を用いた研究により単一遺伝子の変異が生物の寿命や老化に影響を与えることが発見されて以来、寿命・老化を制御する低分子化合物を見つけることは老化研究の大きな目標となっています。私たちは、ある代謝物を培地中に添加することにより、老化モデル系の一つである分裂酵母の経時寿命が延長されることを発見しました。メタボローム解析およびトランスクリプトーム解析から、この代謝物の添加により抗酸化物質であるグルタチオンが蓄積することや遺伝子発現パターンに変化が見られることを見出しました。さらに、代謝物添加による寿命延長効果が見られない変異体を得ることを目的とした遺伝学的スクリーニングを行い、得られた候補変異体の絞り込みを進めています。
(2)細胞内エネルギー代謝を変換させる化合物の探索
がん細胞やミトコンドリア病患者由来の細胞では、その増殖が解糖系に依存しています。そこで解糖系から呼吸へと代謝をシフトさせる化合物を探索し、活性物質を同定しました。本化合物は、神経細胞へ分化することができないミトコンドリア病患者由来のiPSの神経細胞分化を回復させるという驚くべき効果をもたらしました。現在その作用機序を解析しています。
(3) 活性酸素種によるヒトのヘテロプラスミー細胞のホモプラスミー化促進
ミトコンドリアDNA(mtDNA)は、ゲノムDNAよりも高い頻度で変異が起きるため、私たちの細胞のミトコンドリアは老化に伴って変異が急速に蓄積すると言われています。私たちは、野生型と変異型mtDNAを持つ出芽酵母株を融合して人工的にミトコンドリアの混合状態(ヘテロプラスミー)を作ったところ、活性酸素種の存在に依存して組換え依存型複製が起こり、どちらか一方が優性となるホモプラスミー化が促進されることを見いだしました。さらに、生まれつき正常型と変異型mtDNAが混在するミトコンドリア病患者由来のヘテロプラスミー細胞を適度な過酸化水素で処理することで、ホモプラスミー化が促進されることも明らかにしました。これらの結果から、活性酸素種が酵母だけでなく、ヒト細胞においても組換え依存型複製を活性化してmtDNAの複製・分配を促進することが示されました。これを応用して新しいミトコンドリア病治療法の確立を目指すとともに、老化の制御にも挑戦したいと考えています。
 理化学研究所 環境資源科学研究センター ケミカルゲノミクス研究グループ English
理化学研究所 環境資源科学研究センター ケミカルゲノミクス研究グループ English