キーセンテンス:
共役イミンの隠された反応性の開拓と生体分子の新奇修飾、およびその機能の解明
「生体内合成化学治療」の実現:血中内や特定臓器上での反応・試薬開発と生理活性物質合成
分子イメージングによる糖鎖パターン認識の解明と分子ターゲティング
キーワード:
共役イミン、生体分子修飾、合成化学治療、生理活性天然物合成、分子イメージング、糖鎖認識、生体内ターゲティング
研究目的:
有機合成化学の分野では、様々な効率的結合形成反応が開発されていますが、これを生体内や細胞内での標識、あるいは機能性分子の複合化のために積極的に利用する試みは非常に限られています。私達は、生体内アミンに由来する共役イミン誘導体の「見過ごされてきた新奇な反応性」を、生体内アミンが関与する真の生物活性構造をヒントにして、有機合成化学的に再開拓しています。また、これらの反応が生体内で実際に進行していることを証明し、その反応性が持つ「生物学的意義」を解明します。さらにこれら新奇反応を逆に利用して、生きている動物内での生理活性分子の多段階合成にチャレンジしています。例えば、私達が「生体内合成化学治療」と呼ぶ方法で、血中内や標的臓器上での反応や試薬開発を行い、ある時間枠にピンポイントで生理活性天然物を直接動物内で合成して治療の実現を目指しています。このために、糖鎖分子が生体内で行っている複雑な「パターン認識機構」を分子イメージング法により初めて解析するとともに、これを生きている動物内の目的部位に対して、様々な生体分子を自由自在にターゲティングするために積極的に活用しています。平成26年度までに以下の成果を得ています。
『脂質代謝物によるタンパク質翻訳後修飾に学ぶ生理活性天然物合成、および生体内の特定タンパク質上での超生理活性天然物の全ワンポット合成研究』
『共役イミンの6π-アザ電子環状反応による生体高分子や生細胞の革新的PET(陽電子断層撮影)イメージング、および生体分子複合化法の開発』
--------------------------------------------------------------------------------------------------------------------------------------------
(1)『生体内のアミノアルコールやジアミンから得られる共役イミンの新奇反応性開拓とジアミン誘導体の不斉合成』
生体内に存在するある種のアミノアルコールやジアミンから得られる共役イミンが、速やかに[4+2]や[4+4]、さらに[4+2+2]環化反応を起こすことを発見しました。計算化学を用いて、この原因を詳細に調べたところ、隣接位にある水酸基やアミノ基が反応促進に大きく関わっていることを見出しました。私達はこの反応を利用して、これまでに合成することが非常に困難であった光学活性ジアミン化合物をほぼワンステップで高立体選択的に、しかも試薬を混ぜ合わせるだけで簡便に合成することに成功しました。このように、これまでに不安定であったためにほとんど調べられていなかったN-アルキル共役イミンが、実は様々な反応を起こしていることを突き止めるとともに、見出した環化反応を介することで、有機合成化学的に利用可能な反応剤として進化させることができました。さらにこれらの生成物を有機合成反応における新しい触媒として利用する試みも始めています。本研究は、ロシアカザン大学アレクサンドルブトレールフ研究所、長崎大学環境科学科と共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
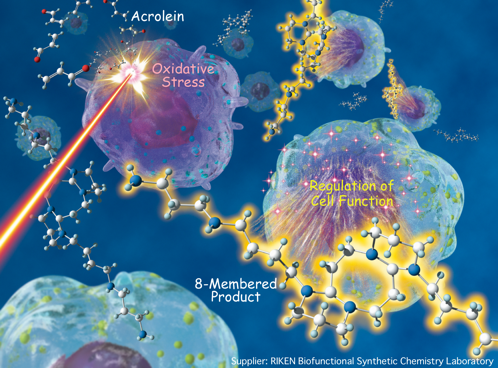
上記1で述べたように、共役イミンが様々な反応を起こすことを突き止めるとともに、これらの「見過ごされていた共役イミンの反応性」が、実は生体内での酸化ストレス過程や機能発現に関与していることを見出しています。すなわち、ポリアミンと、ポリアミンから酸化酵素によって生じる毒性物質アクロレインが速やかに反応し、中間に生じる共役イミンが[4+4] 環化反応を起こします。通常は、生成する8員環化合物(1,5-ジアザシクロオクタン)はアクロレインの毒性を中和しますが、酸化ストレス過程では[4+4]反応が過剰に進行し、8員環化合物のヒドロゲルが生じ、これが酸化ストレスをさらに亢進させると考えています。このように、酸化ストレスにおける新しい機構を提唱するとともに、ポリアミンは酸化酵素によってダイナミックにその構造を変化させていることを発見しました。私達が見出した新奇なポリアミンの反応性は、細胞の増殖や転写活性の制御、さらにはアミロイドの蓄積制御に携っている証拠も掴んでいます。さらに現在、標識体や細胞丸ごとのNMR、あるいは様々な分子生物学的な手法を用いて、私達が発見した「共役イミン反応に基づく生体制御のしくみ」に対して分子レベルでの解析をさらに進めています。本研究は、グローバル研究クラスタ•理研―マックスプランク連携研究センター•システム糖鎖生物学研究グループ、理研前田バイオ工学研究室、理研吉田化学遺伝学研究室、京都大学大学院薬学研究科、早稲田大学先進理工学部と共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
(3)『脂質代謝物によるタンパク質翻訳後修飾に学ぶ生理活性天然物合成、および生体内の特定タンパク質上での超生理活性天然物の全ワンポット合成研究』
タンパク質の構成アミノ酸中でも、アルギニンの翻訳後修飾について、その反応性が有機合成化学的に検討されたことはほとんどありません。私達は、多くの報告例はないものの、アルギニン残基が脂質代謝物により翻訳後修飾を受けることに注目し、アルギニン由来イミンの新しい反応性を追求しました。その結果、ほとんど例のないイミダゾール複素環のライブラリー合成に成功するとともに、この方法を利用して、Ageladine Aを代表とする複雑かつ真に有用な生理活性アルカロイド天然物を、簡単な原料から複数の行程を全て1ポットで全合成することに成功しました。さらに、この全1ポット合成により、関連する様々な生理活性アルカロイド天然物のライブラリー型ワンポット合成を可能とし、天然物を凌駕して医薬品に利用できる超天然物類縁体の探索戦略への道を築きました。また、このように有機合成化学的に開発した全1ポット合成を利用して、細胞内での反応性が低い(従ってバイオオルソゴナルな)アルギニン残基の選択的な標識化や、生きている動物内の特定タンパク質上での生理活性天然物合成の基礎を築きました。さらにこの研究過程において、シアナミドとルイス酸を用いた水中での効率的なアミノ基のグアニジン化法を開発しました。本研究は早稲田大学先進理工学部、および大阪大学大学院理学研究科と共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
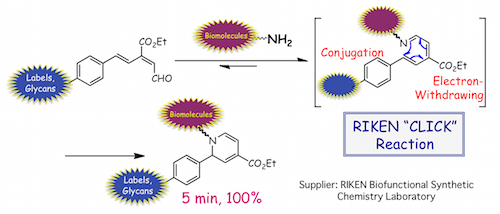
(4) 『共役イミンの6π-アザ電子環状反応による生体高分子や生細胞の革新的PET(陽電子断層撮影)イメージング、および生体分子複合化法の開発』
これまでに私達は、海産天然物による酵素阻害機構に学んだ共役イミンの速やかな6π-アザ電子環状反応を活用して、様々な生体分子や細胞表面のアミノ基を効率的に標識し、PETを代表とする侵襲的(動物を生きたままで)イメージングを実現してきました。さらに第二世代の方法論として、6π-アザ電子環状反応を歪み解消のクリック反応と併用することでさらに進化させ、不安定または極少量のサンプルを含め、様々な生体高分子や生細胞にも適応可能な金属ポジトロン放出核種/配位子標識と、汎用的なPETイメージング法を検討しました。その結果、PET標識とイメージングの効率性を飛躍的に向上させ、さまざまな疾患の診断や生物製剤の開発に大きく貢献するプロトコルを実現しました。一方、同反応を活用して、アミノ基同士を接着させる方法論を新たに開発し、細胞表面やタンパク質上に機能成分子を効率良く導入することにも成功しました。本研究は、理研ライフサイエンス技術基盤研究センター、グローバル研究クラスタ•理研―マックスプランク連携研究センター•システム糖鎖生物学研究グループ、ロシアカザン大学アレクサンドルブトレールフ研究所、理研袖岡有機合成化学研究室、東京医科歯科大学生体材料工学研究所、理研統合生命医科学研究センターと共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
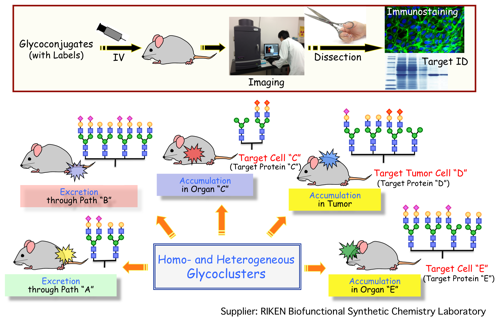
(5)『診断と治療を改革する糖鎖複合体の開発』
上記で開発した6π-アザ電子環状反応を利用して、特殊な細胞や人工デンドリマー基盤に様々な糖鎖構造を導入し、その動態を分子イメージングにより検討しました。その結果、様々な糖鎖構造を使い分けることにより、生きている動物内での臓器や癌組織レベルでの集積や排出プロセスを制御できるだけでなく、さらに細胞レベルの集積までも制御できることが判明しました。さらにこの集積をNMRや計算化学を用いて分子レベルで解析しています。本研究は、上記4で述べたPETに加えてMRIによる診断、さらには放射線治療も視野に入れて検討を行っており、診断と治療を改革する糖鎖複合体の開発に大きな期待が寄せられています。本研究は、理研ライフサイエンス技術基盤研究センター、ロシアカザン大学アレクサンドルブトレールフ研究所、グローバル研究クラスタ•理研―マックスプランク連携研究センター•システム糖鎖生物学研究グループ、仁科センターと共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
(6)『糖鎖の弱い相互作用を効果的に利用した動物内での選択的分子ターゲティング』
糖鎖分子の相互作用は非常に弱いものです。これを著しく向上させ、実際に糖鎖が生体内で行っている認識を実現するために、私達の上記の研究例も含めて、通常はクラスター化して『多価効果』や『パターン認識』を発現させます。一方、これまでにない全く新しい概念として、私達はこの糖鎖の弱い相互作用を逆手に取り、動物内で高い認識を達成します。既に細胞レベルではこれを実現しており、随時成果を報告していきますが、『タンパク質やペプチド分子の強い相互作用』、『糖鎖分子の弱い相互作用』、そして『官能基選択的な結合形成反応』の3者を生体内で同時に働かせることにより、これを可能としました。本研究は、理研ライフサイエンス技術基盤研究センター、グローバル研究クラスタ•理研—マックスプランク連携研究センター•システム糖鎖生物学研究グループと共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
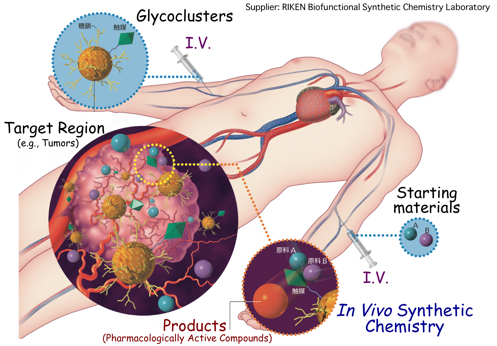
(7)『生きている動物内で生理活性分子を全合成する:『生体内合成化学治療』の実現』
以上述べてきた全ての知見を総合して、研究室の大きな目標の1つである『生体内合成化学治療』に挑んでいます。生きている動物内での糖鎖パターン認識を有効に活用して、動物内の標的臓器上で、ある時間枠にピンポイントで生理活性天然物を直接合成して治療の実現を目指しています。この戦略により、薬剤の副作用やペプチド薬剤の安定性を根本から解決します。既に、細胞表面や動物内で効率的な有機合成化学反応を実現しつつあり、近く研究成果を報告いたします。有機合成化学者が初めて、『生きている細胞や動物内での多段階有機合成』を実現します。本研究は、理研ライフサイエンス技術基盤研究センター、グローバル研究クラスタ•理研―マックスプランク連携研究センター•システム糖鎖生物学研究グループ、バーゼル大学化学科(スイス)と共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
(8)『ごく普通の官能基が示す、細胞内や動物内での「思いもよらない」反応性:生理活性分子検出とその生体内制御の新展開』
さらに、これらの研究過程において、ごく普通の官能基が実は多種多様な反応を示すことを幾つか発見しており(固定観念により隠されて見抜けなかった反応性)、このセレンディピティーを細胞内や動物内での重要な生体物質の検出や、疾患などで過剰発現する生体活性物質の同定、さらには抗体に代わる高感度検出戦略や生体内での分子機能制御へと繋げています。『分子認識』とは全く異なる、『有機合成化学反応』を用いた生体検出と機能制御の新戦略の創出を目指しています。本研究は、理研ライフサイエンス技術基盤研究センター、グローバル研究クラスタ•理研―マックスプランク連携研究センター•システム糖鎖生物学研究グループ、大阪府立大学ナノ科学・材料研究センター、ロシアカザン大学アレクサンドルブトレールフ研究所と共同で実施しています。
--------------------------------------------------------------------------------------------------------------------------------------------
