多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
造血細胞から破骨細胞への分化転換のメカニズム
研究内容
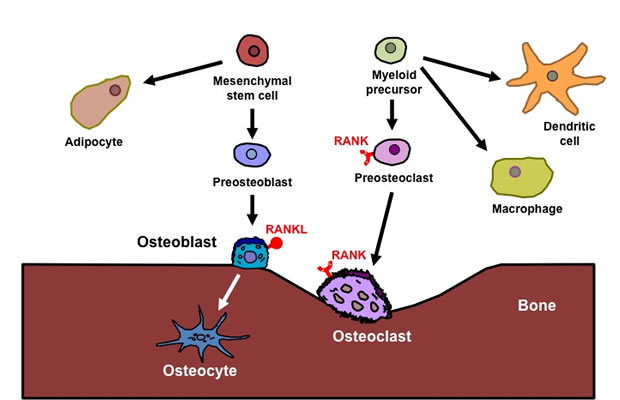
造血系は血液細胞のほかに、骨吸収機能をもつ破骨細胞を分化させ、骨髄という造血のためのスペースと環境を作り出している。破骨細胞の分化や骨吸収機能に障害があると、骨髄が形成されず髄外造血やさまざまな病態が起こる。
骨髄マクロファージが破骨細胞に分化する過程で、M-CSFによる増殖・生存シグナルが必須である。さらに、TNFファミリーのRANKLの刺激下で、細胞周期の停止と細胞融合による多核化、骨吸収実行のための遺伝子発現プログラムが作動する。骨吸収には多量の酸分泌が必要で、エネルギー需要が高く、破骨細胞の寿命は1週間と短い。分化に関わる個々の転写因子としてNF-κB、c-Fos/AP-1、NF-ATc1が知られているが、分化の過程で細胞周期、転写、エネルギー産生、寿命を統合的に制御する分子メカニズムは明らかになっていない。
本研究では、破骨細胞の分化に伴う遺伝子発現の変動やヒストンの修飾を、細胞周期、転写因子、エネルギー代謝、細胞死の視点から解析し、骨吸収と造血を連携する仕組みを明らかにすることを目的とする。
主な論文
- 池田 恭治
-
Ishii K, Fumoto T, Iwai K, Takeshita S, Ito M, Shimohata N, Aburatani H, Taketani S, Lelliott C,J, Vidal-Puig A, and *Ikeda K.
Coordination of PGC-1b and iron uptake in mitochondrial biogenesis and osteoclast activation.
Nat Med. 15: 259-266, 2009.Asaba Y, Ito M, Fumoto T, Watanabe K, Fukuhara R, Takeshita S, Nimura Y, Ishida ,J, Fukamizu A, and *Ikeda K.
Activation of renin-angiotensin system induces osteoporosis independently of hypertension.
J Bone Miner Res. 24: 241-250, 2009.*Ikeda K
Osteocytes in the pathogenesis of osteoporosis.
Geriatr Gerontol Int. 8: 213-217, 2008.Tatsumi S, Ito M, Asaba Y, Tsutsumi K, and *Ikeda K.
Life-long caloric restriction reveals biphasic and dimorphic effects on bone metabolism in rodents.
Endocrinology. 149: 634-641, 2008.Tatsumi S, Ishii K, Amizuka N, Li M, Kobayashi T, Kohno K, Ito M, Takeshita S, and *Ikeda K.
Targeted ablation of osteocytes induces osteoporosis with defective mechanotransduction.
Cell Metab. 5: 464-475, 2007.*Ikeda K.
Vitamin D osteoclastogenesis and bone resorption: from mechanistic insight to the development of new analogs.
Endocr J. 54: 1-6, 2007.Takasu H, Sugita A, Uchiyama Y, Katagiri N, Okazaki M, Ogata E, and *Ikeda K.
c-Fos protein as a target of anti-osteoclastogenic action of vitamin D and synthesis of new analogs.
J Clin Invest. 116: 528-535, 2006 - 竹下 淳
-
Takeshita S,Faccio R, Chappel J, Zheng L, Feng X, Weber , Teitelbaum SL, Ross FP.
c-FMS tyrosine 559 is a major mediator of M-CSF induced proliferation of primary macrophages.
J Biol Chem, 282: 18980-18990, 2007.Faccio R, Takeshita S, Colaianni G, Chappel J, Zallone A, Teitelbaum SL, Ross FP,
M-CSF regulates the cytoskeleton via recruitment of a multimeric signaling complex to c-FMS Y559/697/721.
J Biol Chem. 282:18991-18999, 2007.Zhou P Kitaura H Teitelbaum SL Krystal G Ross FP *Takeshita S.
SHIP1 negatively regulates proliferation of osteoclast precursors via Akt-dependent alterations in D-type cyclins and p27.
J Immunol. 177: 8777-8784, 2006.Faccio R, Takeshita S, Zallone A, Ross FP, Teitelbaum SL. (2003)
c-Fms and the avb3 integrin collaborate during osteoclast differentiation.
J Clin Invest.11 1: 749-758, 2003.Takeshita S, Namba N, Zhao JJ, Jiang Y, Genant HK, Silva MJ, Brodt MD, Helgason CD, Kalesnikoff J, Rauh MJ, Humphries RK, Krystal G, Teitelbaum SL, Ross FP.
SHIP-deficient mice are severely osteoporotic due to increased numbers of hyper-resorptive osteoclasts.
Nat Med. 8: 943-949, 2002.