多方向かつ段階的に進行する細胞分化における運命決定メカニズムの解明究領域略称:細胞運命制御
研究課題名
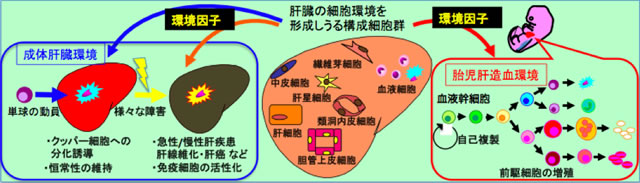
肝臓における造血細胞の運命決定に関わる環境因子の解析

- 連携研究者
- 田中 稔
東京大学分子細胞生物学研究所・
エピゲノム疾患研究センター・
幹細胞制御研究分野・
特任准教授

- 連携研究者
- 伊藤 暢
東京大学分子細胞生物学研究所
発生再生研究分野・助教
研究内容
肝臓は成体における主要な消化器官であるが、生体内の約80%のマクロファージを擁する免疫応答組織でもある。また、肝臓は胎児期における最大の造血組織でもある。申請者らはすでに、肝臓の構成細胞を細胞膜抗原の発現を指標に分離し培養するシステムを確立してきた(JCS 2003;Hepatol 2007;Gastroenterol 2008;Development 2009他)。そこで、こうした細胞の分離・培養法を利用して、肝臓での造血細胞の運命決定に関わる環境因子につき、以下の2点を中心に解析する。
- monocyteは肝臓において肝特有マクロファージであるKupffer細胞へと分化する。また、マクロファージは機能的に異なる複数のサブセットの存在が明らかになっているが、肝障害に伴いKupffer細胞の機能が変化する。そこで、monocyteからKupffer細胞への分化および病態によるKupffer細胞の変化に関与する肝臓の環境因子を明らかにする。
- 一方、胎児肝臓は大量の赤血球を産生するとともに造血幹細胞が劇的に増幅組織でもある。肝臓構成細胞の分離培養法と各種の遺伝子改変マウスを使って、胎児肝造血支持細胞の同定と分化増殖に関わる因子の同定を目指す。
主な論文
- 宮島 篤
-
Yamauchi S, Ito H, and *Miyajima A.
IkBh a nuclear IkB protein positively regulates the NF-kB-mediated expression of pro-inflammatory cytokines.
Proc Natl Acad Sci USA. 107: 11924-11929, 2010.Onitsuka I, Tanaka M, and *Miyajima A,
Characterization and functional analyses of hepatic mesothelial cells in mouse liver development.
Gastroenterology. 138: 1525-1536, 2010.Miyaoka Y, Tanaka M, Imamura T, Takada S, and *Miyajima A.
A novel regulatory mechanism for FGF18 signaling involving cysteine-rich FGF receptor (Cfr) and Delta-like protein (Dlk).
Development. 137: 159-167, 2010.Esashi E, Ito H, Minehata K, Saito S, Morikawa Y, and *Miyajima A.
Oncostatin M deficiency leads to thymic hypoplasia accumulation of apoptotic thymocytes and glomerulonephrritis. Eur J Immunol. 39: 1664-1670, 2009.Chen Y-R, Sekine Ke, NakamuraK, YanaiH, Tanaka M, and Miyajima A.
YB-1 downregulates expression of carbamoyl phosphate synthetase 1 by suppressing C/EBPa function leading to hyperammonemia.
Gastroenterology. 137: 330-340, 2009.Sugano Y, Takeuchi M, Hirata A, Matsushita H, Kitamura T, Tanaka M, and *Miyajima A.
Junctional adhesion molecule-1 JAM-A is a novel cell-surface marker for long-term repopulating hematopoietic stem cells.
Blood. 111: 1167-1172, 2008.Sekine K, Kojima N, Chen Y-R, Ogata K, Fukamizu A, and *Miyajima A.
Foxo1 links insulin signaling to C/EBPα and regulates gluconeogenesis during liver development.
EMBO J. 26: 3607-3615, 2007.Nonaka H, Tanaka M, Suzuki K, and *Miyajima A.
Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors.
Dev Dyn. 236: 2258-2267, 2007.Ito H, Esashi E, Akiyama T, Inoue J, and *Miyajima A.
IL-18 produced by thymic epithelial cells induces development of dendritic cells with CD11b in the fetal thymus.
Int Immunol. 18: 1253-1263, 2008.Miyaoka Y, Tanaka M, Naiki T, and *Miyajima A.
Oncostatin M Inhibits adipogenesis through Ras/ERK and STAT5 signaling pathways.
J Biol Chem. 281: 37913-37920, 2006. - 田中 稔
-
Okabe M, Tsukahara Y, *Tanaka M, Suzuki K, Saito S, Kamiya Y, Tsujimura T, Nakamura K, and Miyajima A.
Potential hepatic stem cells reside in EpCAM+ cells of normal and injured mouse livers.
Development. 136: 1951-1960, 2009.*Tanaka M, Okabe M, Suzuki K, Kamiya Y, Tsukahara Y, Saito S, and Miyajima A.
Mouse hepatoblasts at distinct developmental stages are characterized by expression of EpCAM and DLK1: drastic change of EpCAM expression during liver development.
Mech Dev. 126: 665-676, 2009.Suzuki,K, *Tanaka M, Watanabe N, Saito S, Nonaka H, and Miyajima A.
The p75 neurotrophin receptor marks precursors of hepatic stellate cells and portal fibroblasts in mouse fetal liver.
Gastroenterology. 135: 270-281, 2008. - 伊藤 暢
-
*Itoh T, Kamiya Y, Okabe M, Tanaka M, and Miyajima A.
Inducible expression of Wnt genes during adult hepatic stem/progenitor cell response.
FEBS Letters. 583: 777-781, 2009.Hirose Y, *Itoh T, and Miyajima A.
Hedgehog signal activation coordinates proliferation and differentiation of fetal liver progenitor cells.
Exp Cell Res. 315: 2648-2657, 2009.Saijou E, *Itoh T. Kim K-W, Iemura S, Natsume T, and Miyajima A,
Nucleo-cytoplasmic shuttling of the zinc finger protein EZI is mediated by importin-7-dependent nuclear import and CRM1-independent export mechanisms.
J Biol Chem. 282: 32327-32337, 2007.