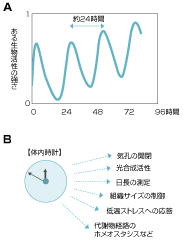
アサガオは朝方に、ヒルガオは日中に花が咲きます。生物が正確に時刻を測り取れるのは、体内に備わっている「体内時計」という機能によります。体内時計は、およそ24時間の周期でリズム「概日リズム」を刻んでいます。
スイカは午前中に花が開くので、その時間に合わせて受粉させるのが家庭菜園では、うまく実らせるコツです。しかし、もし体内時計や概日リズムを人工的に制御することができたら、もっと簡単にスイカを栽培できるかもしれません。「いつか自分の手で体内時計を作ってみたい」――中道範人研究員はその神秘のメカニズムの解明に挑んでいます。
植物の開花時期を司る「体内時計」の機構
植物の体内時計の存在は古くから知られていました。開花だけでなく、気孔の開閉や葉茎の伸長、光合成の活性といった現象も体内時計の制御を受けています。ある植物は、太陽が出ている時間帯に合わせて光合成を活発に行えば、効率的に成長ができるので、日の出前からその準備をしています。また、夜間の冷え込みに備えて、自ら低温ストレス耐性を高める植物もあります。
しかも、植物の体内時計は一日の時間の流れだけでなく、季節の認識にも関与しています。春や秋に咲く花のなかには、日照時間の変化を感知しているものがあります。外部から受ける光刺激の時間的な変化を認識するためには、植物自身が物差しとしての時計を持っていなければなりません。言い換えれば、植物は体内時計が刻む概日リズムと、外部環境の変化とを照らし合わせることで、季節の変化を感知しているのです。(図1)
人類はこれまで経験則的に、育種(品種改良)の過程で植物の体内時計を利用してきました。例えば、オオムギは現在のイラク周辺(チグリス・ユーフラテス川流域)が原産地とされますが、育種により「開花時期が遅れた春蒔き品種」が作られてきました。この品種は、緯度の高い寒冷地でも十分な収穫量を得られ、現在では西ヨーロッパや北米における主要な栽培品種となっています。
この開花時期を決めている機構の一つが体内時計です。
植物の体内時計はこの十数年間で研究が進み、関与している遺伝子群「時計遺伝子」が明らかになってきました。生物の研究でよく使われるシロイヌナズナというモデル生物では、25個以上の時計遺伝子が見つかっています。
「ウォッチ(腕時計)には、ムーブメントやベゼル、リューズなど、数多くの部品が使われています。個々の部品の機能や部品同士の連携の仕組みがわかれば、全体の設計図が描けますから、部品を集めて時計を組み立てることができます。植物の体内時計の研究もそれに近い。現在は時計の部品ともいうべき、時計遺伝子の機能や性質を解析している段階です」(図2)
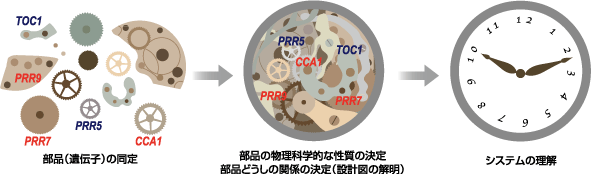
図2 植物の体内時計を解き明かすプロセスは、時を刻む時計を組み立てることと似ている。
概日リズムを作り出している3つのタンパク質
25個の時計遺伝子のうち、中道研究員が特に注目しているのが「PRR遺伝子群(PRR9、 PRR7、 PRR5、 PRR3、 PRR1/TOC1)」です。これまでの研究成果から、PRR9遺伝子とPRR7遺伝子とPRR5遺伝子の3つをすべて欠損すると、概日リズムを消失することが分かっていますが、3つのPRR遺伝子がどのようにして体内時計の制御に関与しているのか、詳しいメカニズムはわかっていませんでした。
一般に、遺伝子の機能はデオキシリボ核酸(DNA)の情報がメッセンジャーRNA(mRNA)に転写され、タンパク質へと翻訳される(タンパク質が合成される)と発現します。3つのPRR遺伝子(PRR9/PRR7/PRR5)からは、それぞれ3つのPRRタンパク質(PRR9/PRR7/PRR5)が作られます。よって、産出されるタンパク質を調べれば、PRR遺伝子と体内時計のかかわりを解くヒントになると考えられます。
実験の結果、3つのPRRタンパク質は、明け方に活発になる時計遺伝子「CCA1 遺伝子」と「LHY 遺伝子」の転写活性を抑制することが分かりました。また、アミノ酸配列の解析によって、3つのPRRタンパク質には共通の転写抑制モチーフがあることが分かりました。
さらに研究を進めると、3つのPRRタンパク質は、植物細胞内においてCCA1 遺伝子とLHY 遺伝子の転写調節にかかわるDNA領域に結合していることが明らかになりました。研究者の間ではPRRタンパク質とDNAが結合することはないと考えられていたため、この結合の発見は従来の常識を覆すものでした。
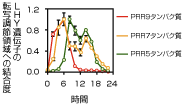
図3 PRR9タンパク質は日の出より2~8 時間後に、PRR7タンパク質は4~14時間後に、PRR5タンパク質は8~16 時間後にCCA1遺伝子とLHY遺伝子の転写調節領域に結合する。(図はLHY 遺伝子の転写調節領域への結合のみ)
「あとは3つのPRRタンパク質が結合する時間帯が問題でした。24時間かけてDNAとの結合を調べたところ、PRR9は朝、PRR7は朝から夜中、PRR5は夕方から夜中と、時間差で順番に結合していることが分かりました。さらに、PRR7遺伝子とPRR5遺伝子の両方を欠損するとCCA1 遺伝子とLHY 遺伝子の「夜間」の転写抑制が、PRR9遺伝子とPRR7遺伝子の両方を欠損すると「昼間」の抑制がそれぞれ解除されたのです」(図3)
3つのPRRタンパク質がDNAに結合する時間は合計で約16時間。これだけの長時間を転写抑制にかかわる3つのPRR遺伝子は、体内時計の24時間周期の中で極めて重要な因子であり、それゆえに、3つすべてを欠損すると概日リズムを刻めなくなるのだと考えられます。
時計遺伝子を理解し、「体内時計」の再現をめざす
それではなぜ3つのPRRタンパク質は順序よく、時間差で結合するのでしょうか。3つのPRRタンパク質が作用しない時間帯はどのようなメカニズムが働くのでしょうか……。たくさんの質問が浮かんできますが、体内時計について分かっているのはまだ一部です。
「3つのPRR遺伝子は言うなれば、一般的な大人が働く時間帯に働く遺伝子群です。朝8時ころから夜12時ころまでなので、三交代勤務の日勤と準夜勤みたいなものですね。CCA1 遺伝子とLHY 遺伝子は早朝に活動を開始し、朝8時ころまで働きます。ELF遺伝子やLUX遺伝子のように夜勤専門の遺伝子もあります。それぞれの遺伝子は独立して動いているのではなく、相互に影響を及ぼし合っていますから、25個の時計遺伝子の相互関係の理解を深めていくことが、体内時計の全貌を解き明かすためのヒントになると思います。研究の過程で、新しい時計遺伝子が見つかる可能性もあります」
体内時計を構成する時計遺伝子の機能が明らかになり、遺伝子同士の関係性が分かれば、全体の設計図が描けます。その情報を基に体内時計を創りだすことができると、より一層、体内時計に対する理解を深めることになります。試薬を試験管に入れて混ぜればできるような簡単な話ではないですが、中道研究員は、植物の体内時計を自分の手で再現するべく日々の研究に励んでいます。
これから先の研究では、幅広い視点が求められることになります。分子生物学は、体内時計を解き明かす際の核となる学問領域ですが、人工的に概日リズムを作り出し、安定的に周期を刻むためには数学や物理、工学の発想も欠かせません。また、体内時計は植物だけでなく、人間にも動物にも菌類にも備わっています。春になると花が咲き、ミツバチが集まって来るのは偶然ではありません。生態学や動物行動学との共同研究によって、生物間の相互作用が解き明かされる可能性があります。
オリジナリティにあふれる研究を手がけ、若い世代に生物学の面白さを伝える
植物の体内時計の身近な応用例として、新エネルギーの一翼として注目を集めるバイオマスが挙げられます。実は、3つのPRR遺伝子が発現しなくなると、開花時期が遅れ、それと同時に乾燥や温度変化などのストレスに強くなり、最終収量が増えることが分かっています。このような特性を備えた植物を遺伝子工学の手法で開発すれば、バイオマス資源を効率良く生産することも可能かもしれません。
「食糧問題にも貢献し得ると思います。地球上には極端に寒かったり暑かったり日照時間が短かったりと、農業が難しい地域が点在しています。その地域の気候や風土に合う品種を開発し、安定的に食糧を確保できるようになれば、多くの人々が飢えから救われます。従来の育種では、優れた特徴を持つ変異体(ミュータント)を選りすぐって掛け合わせ、性質を定着させるのですが、体内時計の理解が充分に深まっていれば、ミュータントの選抜が的確かつ迅速にできると期待されます。あるいは、遺伝子組み換え技術を使えば、より短期間で開発することも可能です」
いずれにしても、体内時計という大本のメカニズムの理解がなければ何もできません。今回の研究で大変だったのは、植物細胞内でのPRRタンパク質とDNAの結合を証明することでした。結合していないというデータが出ても、それは不適切な条件で実験を行っていただけかもしれず、結合を否定する証明にはなりません。また結合したデータが出ても、従来の予想と反する結果を発表するためには、結合データそのものをさらに裏付けるデータも求められます。そこで、中道研究員は実験条件の参考となる論文を読みあさり、実験材料、試薬、道具、実験環境などの条件を一つずつ整えていきました。その結果、PRRタンパク質とDNAが結合するタイミングまでも世界で初めて明らかにできたのです。
「名古屋大学に拠点を移し、若い世代との接点が増えたことで『もっとオリジナリティ溢れる研究をしよう』との思いが強くなりました。なぜなら、高校生や大学生に『生物って面白い!』と思ってもらうことが生物を志す人を増やし、結果として、フロンティアが広がっている生物学の世界の発展にもつながると思うからです」

中道範人(Norihito Nakamichi)
静岡県出身。名古屋大学大学院 生命農学研究科卒。日本学術振興会 特別研究員(PD)、理化学研究所 基礎科学特別研究員を経て現職。名古屋大学 高等研究院 特任助教及び大学院生命農学研究科 特任助教を兼任。