病原菌が鉄を獲得するしくみ
〜ヘム輸送に関わる膜タンパク質〜
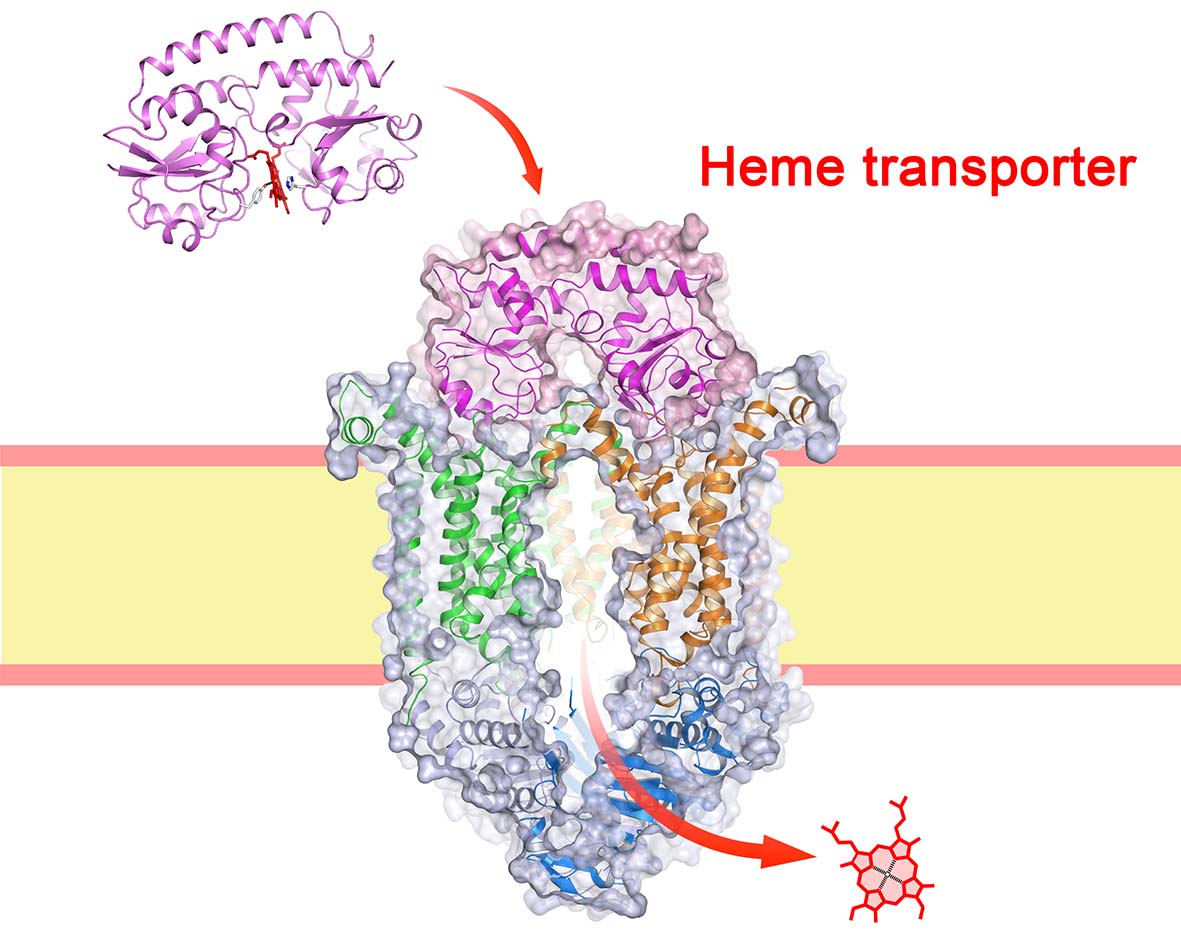
病原菌は血液のヘムから鉄分を補給する
動物・植物・微生物にいたるほぼすべての生物は,鉄を栄養素として補給する必要がある.なぜなら,生体内では酸素の運搬や様々な生理活性物質の生合成,エネルギー変換,DNA合成といった大事な反応に関与するタンパク質が鉄イオンをうまく利用しているためである.ヒトに感染するバクテリアも例外ではない.病原菌の多くは,宿主の赤血球内のヘモグロビンからヘムを取り入れて鉄を獲得することで増殖することが知られており、ヘムの輸送システムは抗菌剤やワクチン開発のターゲットとしても注目されている [1,2](図1a, 1b).当研究室では、バクテリアがヘムを獲得する際に細胞質内へと膜輸送を行うために機能しているタンパク質である「ヘムトランスポーター」のX線結晶構造に成功している. その分子メカニズムについて以下に解説する.
生体エネルギーであるATPを利用した構造変化
病原菌が自身の細胞内へとヘムを取り込むための膜タンパク質であるヘムトランスポーターは,生体エネルギー物質であるATPの加水分解反応を駆動力として利用するATP-binding cassette (ABC)トランスポーターファミリーに属する.これまでに,バクテリアからヒト由来のものまで10種類以上のABCトランスポーターのX線結晶構造が決定されている.しかし,これらトランスポーターによる基質認識の特異性や選択性,ATPの結合・加水分解反応と基質輸送の共役という基本的なメカニズムについて詳細な理解にまで至っていない [3].それは,ABCトランスポーターの種類ごとに動作するメカニズムが必ずしも共通していないということに加えて,輸送反応の各ステップの構造や構造変化の過程を捉える事ができていないためである.
ヘムトランスポーター分子の大きな構造変化
そこで、当研究室では、院内感染や多剤耐性菌として知られるバークホルデリア・セノセパシア菌由来ヘムトランスポーターのX線結晶解析を行った [4](図1c).この解析では、ヘムトランスポーターへとヘムを受け渡すタンパク質であるペリプラズムヘム結合タンパク質(PBP)が複合体を形成した状態を初めて捉えたものである.膜貫通サブユニット(TMD)とATP結合サブユニット(NBD)が2:2の複合体を形成する.ヘムトランスポーターのTMD領域のフォールドは,薬剤排出やアミノ酸や糖の取り込みを担うタイプのABCトランスポーター [5, 6]とは大きく異なっており,合計20本のαヘリックスで構成される.ヘムやATPは結合していない.その中央には縦に細長い空洞状のヘム輸送経路(チャネル)が存在し,ヘムの出口となる細胞質側に大きく開いた”inward-facing(内開き)”のコンフォメーションの状態である(図1d).したがって、一連の反応サイクル中ではヘム輸送が完了した後の状態 (post-translocation state)と見なせる.一方,図1eは、2012年に報告されたペスト菌由来のヘムトランスポーターの ”outward-facing(外開き)”のコンフォメーションであり,細胞質側の出口部分は疎水性残基によって完全に閉じているが,ペリプラズム側にはちょうどヘムが1分子入るくらいの大きさのポケットがある.この状態は休止型(resting state)の構造を反映していると考えられる.これら2つの構造のコンフォメーションを比較すると、TMD領域のチャネルを形成する構造の違いは明らかで,ヘムの輸送を行うには,膜貫通ヘリックスの大規模な再配置によってチャネルの2カ所の出口が開閉するという仕組みが明らかとなった.
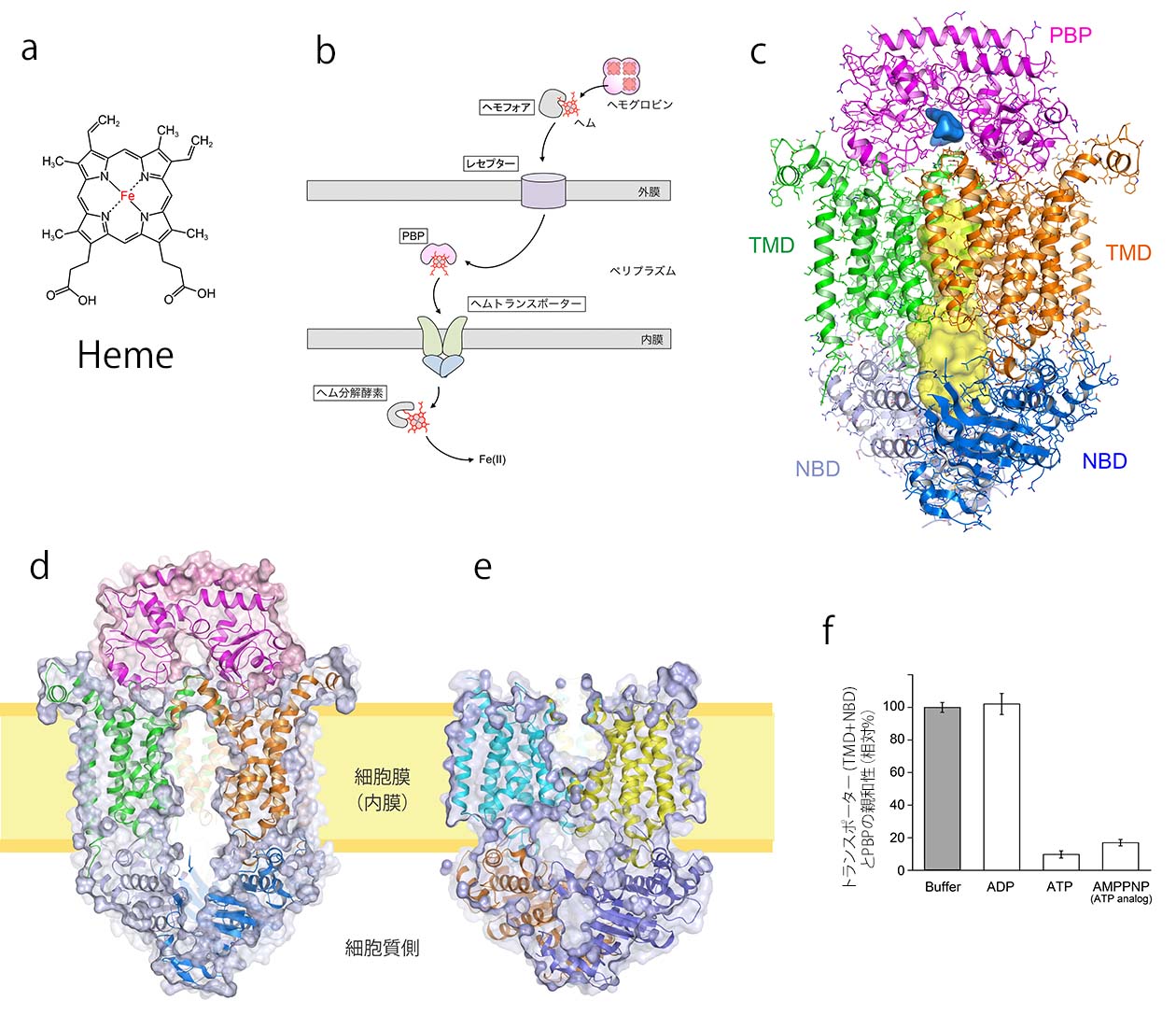
図1. ヘム輸送チャネルの構造 (a) ヘムの分子構造. (b) グラム陰性菌のヘムの取り込み過程の模式図.(c) バークホルデリア・セノセパシア菌のヘムトランスポーターの内開き構造をリボンモデルで示した.ヘムトランポーターの膜貫通サブユニット(TMD)とヌクレオチド結合サブユニット(NBD)が2分子ずつ会合しており、ペリプラズムヘム結合タンパク質(PBP)がヘムトランポーターと複合体を形成してヘムを渡す.PBPのヘム結合ポケットを青色のサーフェイスで示す.TMDは合計20本のαヘリックスを形成し、縦に細長い輸送チャネル(黄色のサーフェイス表示)を形成していた. (d) 分子表面モデルの断面を示す.細胞膜を貫通する部分の中央には縦に「チャネル」と呼ばれる細長い空洞があり、細胞質側へ出口が開いた状態にある(内開き構造).ヘムは、このチャネルを通って細胞内へ輸送される.(e) ペスト菌由来のヘムトランスポーターでは輸送チャネルが外開きの状態で構造解析された. (f) プルダウン法によるPBPとヘムトランスポーターの相互作用解析.トランスポーターにATPが結合することでPBPとの親和性が低下することを示す.(文献4から改変)
PBPからヘムを渡す
今回明らかになった構造にはヘムは結合しておらず、図1Cに示すように,PBP内のヘムが結合するスペースはTMDサブユニットから少し突き出した短いヘリックスH5aによって占有されている。おそらく,ヘムが結合したPBPがTMDと複合体を形成する際には,TMDがPBPの2つのドメインを押し広げてヘムの親和性を低下させ,TMDにヘムが移動した後にはこのH5aヘリックスによるゲートが閉じることでヘムの逆流を防いでいると考えられる.一方,ATPの結合がヘムトランスポーターからPBPの解離を促すということが生化学的な実験から明らかとなっており(図1f),ATPの結合はトランスポーターのコンフォメーションを内向きから外向きに変換,つまりヘムの透過と初期状態にリセットする2つの役割をもつことが示唆されている [4].
膜貫通領域でヘムを効率よく輸送するメカニズム
立体構造解析によって明らかになったヘム輸送チャネルの性質は興味深い.ヘムトランスポーターの内開き状態の構造で観測された細長いヘム輸送チャネルの表面を構成するのはモノマーあたり28個の残基である.それらの3分の2は疎水性残基であり,残りが親水性の残基である.これまでにX線結晶構造解析によって明らかになった他のトランスポーターやイオンチャネルなどの例では、輸送経路に基質が一時的にトラップされる部位がある場合が多いが,ヘムトランスポーターの輸送チャネルの表面にはヘムの配位子となりうるような側鎖は存在しなかった.しかし,ヘム輸送チャネル表面で唯一の荷電性残基としてアスパラギン酸残基(Asp112)が存在しており(図2a),病原菌のヘムトランスポーターの間で保存されている.興味深いことに,外開きの構造では,この残基は他の残基に埋没していた(図2b).このAsp112の露出度がヘムトランスポーター分子全体の構造変化によって制御されている可能性がある.Asp112を変異させるとヘム輸送活性は野生型と比べて低下することすることが示された.ヘムは負電荷と疎水的な部分の両方を持っている分子である.これらのことから、チャネルの内部に取り込まれたヘムが効率よく細胞質側へと移動するためのメカニズムとして,ヘムがチャネルの表面の負電荷と反発して速やかに細胞質へ出ていくことが推測される[4].
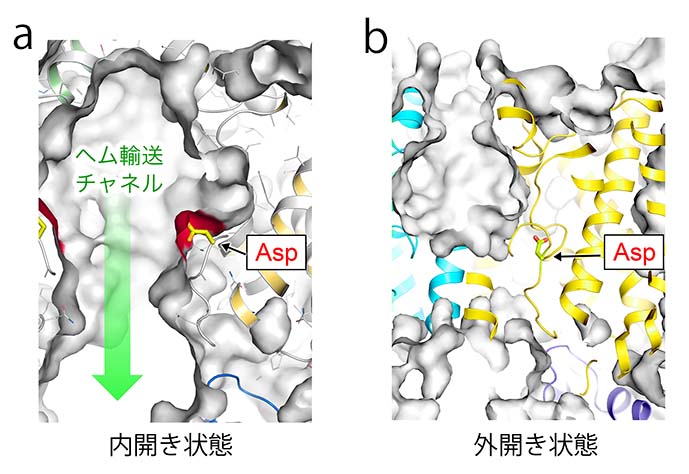
図2. (a) 細胞質側に開いている内開きの状態ではアスパラギン酸側鎖(Asp112)がチャネル表面に露出している.この部分は負電荷をもつことから、ヘムと反発することで速やかに運ばれると考えられる.(b) 外開き構造ではこの残基は分子内部に埋もれた状態にある.
展望
ATPの加水分解を駆動力とするヘムトランスポーターの分子メカニズムの一端を紹介したが、現状ではまだ輸送のメカニズムの一部分が明らかになったに過ぎず,ヘムが輸送される際のヘムの移動のメカニズムについては解明できていない.ヘムの獲得・輸送システムには様々なタンパク質が関与しているが,共通して言えるのは,タンパク質は複合体形成の際の構造変化やエネルギー駆動力を用いてヘムの受け渡し機能を発揮している.したがって,そのメカニズムを詳細に理解するには、局所的な構造の変化と、それに連動して起こるタンパク質分子全体のコンフォメーション変化の解析が必要である.各ステップや中間状態の情報については,我々は2019年に「京」コンピュータを使った構造変化のシミュレーションを行っており[8]、現在は分光法を利用したカイネティクス解析やクライオ電子顕微鏡での解析を進めている。
参考文献
[1] Wandersman, C., Delepelaire, P., “Bacterial iron sources: from siderophores to hemophores”, Annu Rev Microbiol, 58, 611-647 (2004) [doi]
[2] Wilks, A., Burkhard, K.A., “Heme and virulence: how bacterial pathogens regulate, transport and utilize heme”, Nat Prod Rep, 24, 511-522 (2007) [doi]
[3] Locher, K.P., “Structure and mechanism of ABC transporters”, Curr Opin Struct Biol, 14, 426-431 (2004) [doi]
[4] Naoe, Y., Nakamura, N., Doi, A., Sawabe, M., Nakamura, H., Shiro, Y., Sugimoto, H., “Crystal structure of bacterial haem importer complex in the inward-facing conformation”, Nat Commun, 7, 13411 (2016) [doi]
[5] Aller, S.G., Yu, J., Ward, A., Weng, Y., Chittaboina, S., Zhuo, R., Harrell, P.M., Trinh, Y.T., Zhang, Q., Urbatsch, I.L., Chang, G., “Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding”, Science, 323, 1718-1722 (2009) [doi]
[6] Oldham, M.L., Khare, D., Quiocho, F.A., Davidson, A.L., Chen, J., “Crystal structure of a catalytic intermediate of the maltose transporter”, Nature, 450, 515-521 (2007) [doi]
[7] Woo, J.S., Zeltina, A., Goetz, B.A., Locher, K.P., “X-ray structure of the Yersinia pestis heme transporter HmuUV”, Nat Struct Mol Biol, 19, 1310-1315 (2012) [doi]
[8] Tamura, K., Sugimoto, H., Shiro, Y., Sugita, Y., “Chemo-Mechanical Coupling in the Transport Cycle of a Heme ABC Transporter”, J Phys Chem B, 123, 7270-7281 (2019) [doi]