第9節 極微量タンパク質解析のための超高感度アミノ酸分析
はじめに
アミノ酸分析法は,遊離アミノ酸や,タンパク質・ペプチドのアミノ酸組成・アミノ酸含量を定量する手法である。プロテオミクスやエピジェネティクスなどの生化学・分析化学といった基礎研究から食品・工業品の分析などの産業利用,医薬品の試験・分析や,健康診断などの医療応用までアミノ酸分析法の応用範囲は広がっている。中でも,タンパク量の絶対定量に関しては,共存塩や結合水が存在するため秤量では難しく,色素結合法などタンパク質の呈色定量法は,構成アミノ酸の種類や配列に依存しタンパク質によって変動するため,現在,タンパク質の種類によらず正確にタンパク量を定量できるのはアミノ酸分析法のみである。また,プロテオミクス研究やエピジェネティクス研究においては,タンパク質の翻訳後修飾の定量的解析が重要であるが,標準物質があれば,アミノ酸分析を用いて翻訳後修飾アミノ酸などの異常アミノ酸の同定・定量も可能である。このようにアミノ酸分析法の定量性は,タンパク質分析において非常に強力なツールであり,ニンヒドリン法を用いた自動アミノ酸分析装置も市販されている。しかしニンヒドリン法は検出感度が低く,微量分析に活用するのは難しかった。微量のタンパク質を分析するためには,微量タンパク質を定量的に加水分解する技術,得られたアミノ酸を高分離で分離するシステム,アミノ酸を高感度で検出するための誘導体化試薬と検出器,すべての操作を環境からの汚染(コンタミネーション)なく行う技術,これらすべてが分析の成否を決める重要な要素となる。我々はそれらの要素を最適化することで,サブピコモルレベルのアミノ酸を定量できる,超高感度アミノ酸分析法を開発した1)。本節では我々の開発した超高感度アミノ酸分析法と従来のアミノ酸分析法と比較しながら,極微量タンパク質を解析するために必要な,極微量加水分解技術,アミノ酸の誘導体化,クロマトグラフィー技術について概説する。
1. アミノ酸分析の歴史
Mooreの開発したニンヒドリン法のように,カラムでアミノ酸を分離してから誘導体化して検出する方法をポストカラムラベル化法という。この方法の利点は分離後に誘導体化するため夾雑物の影響を受けにくいこと,専用の装置が必要となるが分析を自動化できることから,得られるデータの信頼性が高くなることである。最近これらの方法については,イオン交換クロマトグラフィーを用いるため分離能が低く分析時間がかかる,ニンヒドリン検出による感度が低い,すなわち多量の試料を必要とする,といった欠点が指摘されている。感度に関しては,蛍光試薬o-フタルアルデヒド(OPA)を用いたポストカラムラベル化法が開発され,1桁高感度化した6)。OPAはチオール化合物の存在下1級アミンと反応するが,2級アミンとは反応しない。しかし次亜塩素酸ナトリウムなどで酸化し誘導体化することで,プロリンなどの2級アミンの分析も可能になる。
もう一つの誘導体化法としてアミノ酸を分離する前に誘導体化するプレカラムラベル化法がある。プレカラムラベル化法の利点は,疎水性の高い誘導体化試薬を用いることで,分離能の高い逆相クロマトグラフィーでの分離が可能になるため,短い分析時間と高分離の両立ができる点と,蛍光誘導体化試薬を用いることで,ニンヒドリン法より3,4桁の感度向上ができることが挙げられる。そのためプレカラム法用の様々な蛍光誘導体化試薬が開発された7-11)。一方欠点としては,誘導体化試薬とアミノ酸との反応が定量的に進まない場合があること,誘導体化アミノ酸の安定性が低い場合があること,アミノ酸分離前に誘導体化するため夾雑物に弱い(誘導体化試薬と反応するアミノ酸以外の成分による妨害ピークや,共存する塩や界面活性剤によって誘導体化反応が阻害される)こと,大過剰の誘導体化試薬を除去する必要があること,といった点が挙げられる。本研究では,これらの欠点が克服された蛍光誘導体化試薬,6-アミノキノリル-N-ヒドロキシスクシンイミジルカルバメート(AQC)を用いて分析を行った1,10)。この試薬については後述する。 また,誘導体化を行わないでアミノ酸を分析する方法として,キャピラリー電気泳動やHPLCと質量分析法による検出を組み合わせた方法も提案されている12-14)。
2. タンパク質の加水分解
微量分析では,外部の環境からのコンタミネーションが起こらないように細心の注意を要する。アミノ酸分析の場合,特に加水分解前に試料以外のタンパク質が混入してしまうと,アミノ酸レベルまで分解されたときに区別がつかないため,分析に大きな支障を生じる。そこで,精度よく加水分解を行うことが必要であるが,加水分解操作は試料の乾固,塩酸(および必要な場合はフェノール結晶)の添加,減圧封管と煩雑で熟練を要する。そこで,なるべく人の手を介さず加水分解を自動化することがのぞましい。しかし,塩酸を用いた加水分解をそのまま自動化するのは,塩酸によって流路が腐食されるなどして難しいため,最近我々は,新たに固体酸触媒を用いたタンパク質の加水分解法を開発することで加水分解の自動化に成功した10)。詳細は文献にゆずり,本節では標準的な加水分解法として塩酸気相加水分解法について説明する。
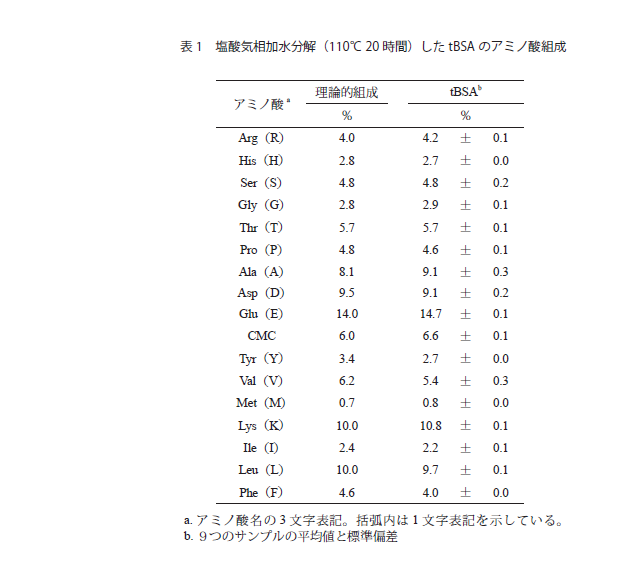
塩酸加水分解の場合,通常,110℃20時間加熱を行う。これにより,ほとんどのペプチド結合が切断されアミノ酸が回収されるが,トリプトファン,システイン,シスチンは,多くが破壊される。アスパラギン,グルタミンはそれぞれ,アスパラギン酸,グルタミン酸として回収される。さらにセリン,トレオニン,バリン・イソロイシンの回収率が低くなる傾向がある。これは水酸基を持つセリン・トレオニンは分解されて減少する一方,β位に分岐を持つバリン(V),イソロイシン(I)を含むペプチド(V-V, V-I, I-V, I-I)は加水分解速度が他のペプチド結合に比べ著しく遅いためである19)。そこで,加水分解時間を24時間,48時間,72時間と変化させ,セリン,トレオニンは0時間外挿値を用い,バリン,イソロイシンはアミノ酸回収率が一定になった値(通常72時間加水分解した値)を採用する。また,システイン・シスチンに関してはタンパク質を加水分解前に還元・アルキル化するなどして保護して加水分解を行うと定量的に回収できる。トリプトファンは塩酸加水分解では分解されてしまうが,チオールを多量に添加することで分解を抑えられる。また,正確にトリプトファンを定量したい場合には,2g/Lのトリプタミンを含む4Mメタンスルホン酸を使うと定量的に回収できる。微量試料の場合,塩酸加水分解時にチロシン,メチオニンが減少することもあるが,フェノールを添加して塩酸によるチロシンのハロ化を抑え,脱気を十分に行うことでメチオニンの酸化を防ぐと定量的に回収できる。
2.1 必要な試薬,器具
定沸点塩酸,フェノール結晶,10pmol/uLのアミノ酸標準溶液(市販の加水分解サンプル分析用の17種のアミノ酸(それぞれ2.5mmol/L)を含む標準アミノ酸混合溶液を希釈したもの),10pmol/uLの内標(ノルバリンなど)水溶液,ミニナートバルブ,遠心エバポレーター,真空ポンプ,ブロックヒーター,加水分解用小試験管(たとえば6×32mm),加水分解用ガラスバイアル(たとえば27.75mm×70mm)。これらのガラス器具(小試験管とガラスバイアル)はコンタミネーションを防ぐため,あらかじめ550℃3時間乾熱するので,ホウケイ酸ガラス(borosilicate glass)製を利用する。
2.2 プロトコル
- ガラス器具を550℃3時間乾熱する。
- タンパク質溶液を内標とともに加水分解用小試験管に入れ,遠心エバポレーターで乾固する。加水分解用標準アミノ酸溶液(典型的には各50pmolのアミノ酸を含む)も同様に内標を加えたのちに乾固する。
- 加水分解用ガラスバイアルに,フェノール結晶を1~2かけら(約1~2mg)添加し,定沸点塩酸200μLを加える。
- 3 のバイアルに 2 の小試験管を入れ,ミニナートバルブをバイアルにとりつけ,バイアルを減圧・脱気し,封管する。
- アルミブロックヒーターにバイアルを入れ,加水分解する(110℃20時間)。
- 加水分解後,小試験管を取出し,遠心エバポレーターで乾燥させ分析に用いる。
操作者由来のタンパク質の混入を防ぐため,作業はすべてグローブをつけて行うとともに,外部の環境からの汚染を防ぐためグローブボックス内で行う。さらに,サンプルの脱気,封管,加水分解は,サンプルの酸化を防ぐため,窒素を充てんしたグローブボックスなど無酸素状態で行うことを推奨する。
3. アミノ酸の誘導体化
3.1 必要な試薬
20mM塩酸,0.2Mホウ酸緩衝液(pH 8.8),AQC溶液(AQC粉末を3mg/mL,約10mMの濃度で,アセトニトリルに溶解させたもの),10pmol/uLのアミノ酸標準溶液
3.2 プロトコル
アミノ酸キャリブレーション標準溶液:内標・10pmol/uLスタンダード各50pmol分,0.2Mホウ酸緩衝液(pH 8.8),AQC溶液を1:3:1の割合で混合し,直ちに撹拌後,55℃10分間加熱する。
加水分解物:加水分解後乾燥させた小試験管に20mM塩酸,0.2Mホウ酸緩衝液(pH 8.8),AQC溶液を1:3:1の割合で混合し,直ちに撹拌後,55℃10分間加熱する。
典型的には,いずれも全体積で50uLになるように調製し,その1/10をカラムにインジェクションして分析する。
3.3 留意点
- AQCは水分があるとただちに加水分解されるため,溶解に用いるアセトニトリルはHPLC用など水分含量が痕跡量のものを使用する。望ましくは超脱水アセトニトリルを使用する。AQC溶液は,超音波洗浄機に10秒ほどかけたのちに,55℃で加温し,AQCを完全に溶かす。
- AQC溶液はサンプル溶液に添加した後,ただちに撹拌する。
- 塩や界面活性剤がある程度共存していても,誘導体化反応は定量的に進むが,トリス-塩酸緩衝溶液のようにアミノ基を持つものは,AQCと反応しAQCを消費してしまうため,使用しない。
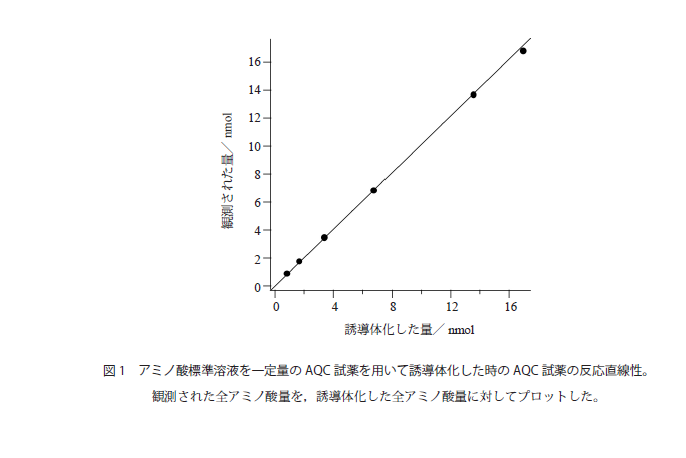
- サンプル中のアミノ酸量と比較してAQCが十分量ない場合,反応が完全に進まないうえに,アミノ酸によってその程度が変わるため,正確な定量ができなくなる。アミノ酸量を変化させた時の定量値について,どこまで直線性が保たれるか確認しておくとよい。図1に種々の量のアミノ酸標準溶液を一定量のAQC試薬を用いて誘導体化した時の,アミノ酸定量値をプロットした。この場合,全アミノ酸量14nmol程度まで反応の直線性が保たれているが,17nmolではAQCの量が十分ではなく,定量値が低くなっている。タンパク質加水分解物を分析する場合には,常に全アミノ酸量がどれくらいになるかを念頭に,必要ならば加水分解後にサンプルを希釈することが必要である。
4. クロマトグラフィー
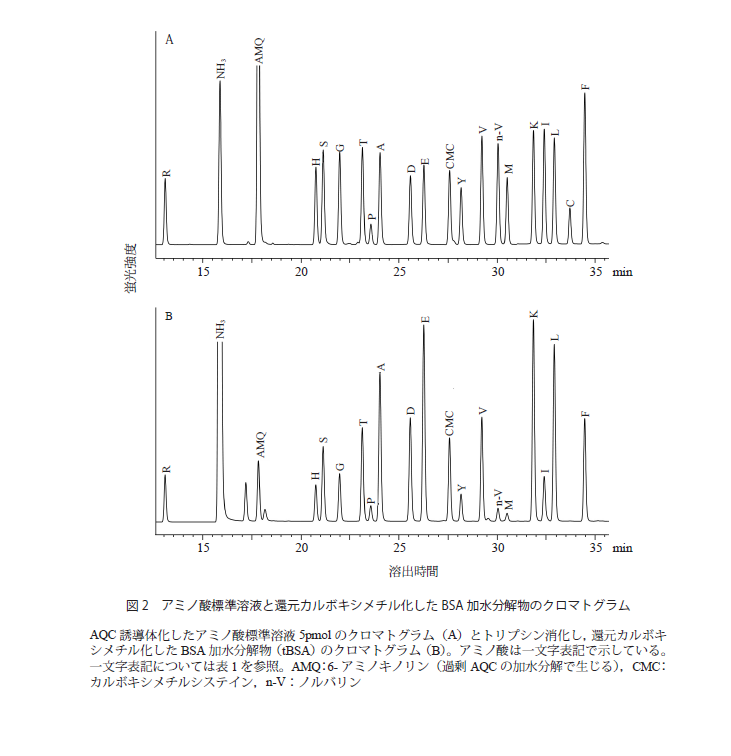
アミノ酸の定量は,標準アミノ酸混合液を分析し,そのピーク高さまたは面積を基準に行う。標準アミノ酸混合液はトリプトファン,アスパラギン,グルタミンを除いた17種のアミノ酸からなる。これは,標準的な方法である塩酸加水分解によって,前述のとおりトリプトファンはほとんど破壊されること,アスパラギン,グルタミンはそれぞれ,アスパラギン酸,グルタミン酸になるためである。したがってアスパラギン酸,グルタミン酸の分析値は,それぞれアスパラギン+アスパラギン酸,グルタミン+グルタミン酸の値となる。
定量されたアミノ酸量から,タンパク量を求める方法には2通りある。ひとつは,得られたアミノ酸のモル数に,それぞれのアミノ酸残基質量をかけて合計する方法である。タンパク質のアミノ酸配列の情報がなくてもタンパク量がわかるという利点があるが,加水分解中に破壊されてしまうアミノ酸は考慮することができない。もう一つの方法は,タンパク質のアミノ酸配列が既知の場合,得られたアミノ酸のモル数を各アミノ酸の理論的な残基数で割ることでタンパク量を求める方法である。理想的には,どのアミノ酸を使って計算しても同一の値(=タンパク量)が得られるはずであるが,前述したように,加水分解中に破壊されたり,十分に加水分解されないアミノ酸もあるため,この方法を用いるときは回収率の高い安定なアミノ酸を選択するとよい。我々は通常,アラニン,フェニルアラニン,ロイシンの量から得られたタンパク量を平均して算出している。
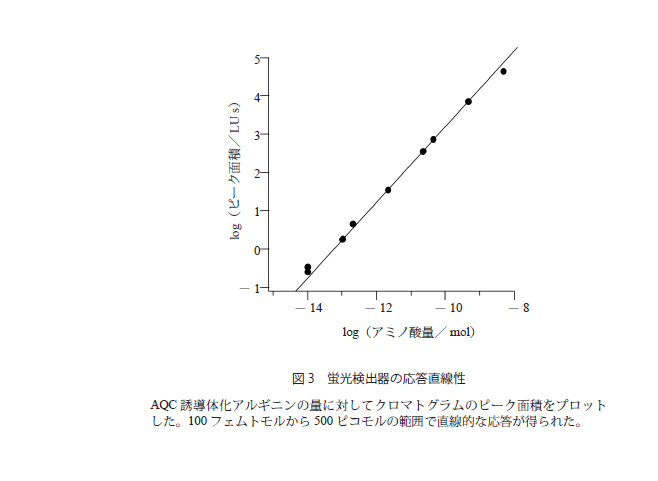
このような定量を行う場合,検出器の応答の直線性も重要である。蛍光検出器の場合,微弱な蛍光を検出するために,光電子増倍管という信号を増幅する装置を用いる。この光電子増倍管は,印加する電圧を高くするほど,感度が高くなるがノイズも大きくなるため,電圧を変えられる装置であれば,サンプル量などに対応して適当な電圧を選択するとよい。また蛍光検出器は,入力信号に対して,通常2桁から4桁の直線性を示すように設計されているが,その範囲は印加電圧によっても変化するので,前もってチェックしておくとよい。アルギニンの量を変えてAQC誘導体化し,得られたクロマトグラムのピーク面積をプロットしたものが図3である。この場合,100フェムトモルから500ピコモルの範囲で直線的な応答が得られた。
4.1 必要な試薬・装置
溶離液A:95% 30mM リン酸緩衝液(pH 7.3)+ 5mM テトラブチルアンモニウムブロミド,5% アセトニトリル(HPLCグレード)
溶離液B:50% 30mM リン酸緩衝液(pH 7.3), 50% アセトニトリル(HPLC グレード)
HPLC:2 液混合グラジェント溶離ができるもの,高耐圧クロマトグラフィー,Agilent 1200 SL など
カラム:高耐圧逆相カラム,InertSustain C18HP(3 × 250mm,3μm,耐圧50MPa)など
4.2 プロトコル
下記のグラジェントでAQC 誘導体化アミノ酸を溶出した後,1.8 分間カラム洗浄(99%B),12.4 分間カラム平衡化し次のサンプルの分析を行った。
グラジェント:%B 2-7.3-72.3-99 / 0-2.7-35.4-36.3 min
注入体積:5uL
カラム温度:42℃
流速:0.4mL / min
蛍光検出:励起波長250nm,蛍光波長395nm
5. 実験例
おわりに
蛍光誘導体化試薬AQC を用いることで微量タンパク質の高感度アミノ酸分析が可能になった。しかし微量タンパク質の正確な定量を行うためには,環境からの汚染を防ぐため微量サンプルを取り扱う正確なハンドリングが重要である。特に,加水分解前の汚染は致命的なため,細心の注意が必要である。本節では高感度アミノ酸分析のプロトコルについて,微量タンパク質の加水分解から解説した。このプロトコルによって,10 ピコモル程度の微量タンパク質でも定量的に分析できることを示した。我々はさらに微量サンプルのアミノ酸分析を行うために高感度化を進め,現在はフェムトモルレベルのアミノ酸定量も可能となっている。興味のある方は文献を参照されたい21)。これらの技術が基礎研究のみならず,産業利用や医療にも役立つことを期待している。
